碳、硅同为周期表中ⅣA族的元素,是构成自然界各种物质的重要元素.
(一)由碳元素构成的各种单质和化合物都是科学家研究的重要对象.
(1)用特殊方法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下方法提纯,请配平该反应的化学方程式:
______C+______KMnO
4+______H
2SO
4→______CO
2↑+______MnSO
4+______K
2SO
4+______H
2O
(2)汽车尾气中的一氧化碳是大气污染物,可通过反应:CO(g)+
O
2(g)?CO
2(g)降低其浓度.
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示.请填写表中的空格.
| 容器编号 | c(CO)/mol?L-1 | c(O2)mol?L-1 | c(CO2)mol?L-1 | v(正)和v(逆)比较 |
| Ⅰ | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | v(正)=v(逆) |
| Ⅱ | 3.0×10-4 | 4.0×10-4 | 5.0×10-2 |
v(正)______v(逆) |
②相同温度下,某汽车尾气中CO、CO
2的浓度分别为1.0×10
-5mol/L和1.0×10
-4mol/L.若在汽车的排气管上增加一个补燃器,不断补充O
2并使其浓度保持为1.0×10
-4mol/L,则最终尾气中CO的浓度为______mol/L(请保留两位有效数字).
(3)CO
2在自然界循环时可与CaCO
3反应,CaCO
3是一种难溶物质,其K
sp=2.8×10
-9.CaCl
2溶液与Na
2CO
3溶液混合可形成CaCO
3沉淀,现将等体积的CaCl
2溶液与Na
2CO
3溶液混合,若Na
2CO
3溶液的浓度为2×10
-4mol/L,则生成沉淀所需CaCl
2溶液的最小浓度为______.
(二)晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用过量的碳还原二氧化硅制得粗硅
②粗硅与干燥的HCl气体反应制得SiHCl
3③SiHCl
3与过量的H
2在1000℃~1100℃反应制得纯硅,已知SiHCl
3能与水强烈反应,在空气中易自燃.请回答:
(1)第一步制取粗硅的化学方程式______.
(2)粗硅与HCl反应制备三氯氢硅的过程中发生反应的热化学方程式为:
(i)Si(s)+3HCl(g)═SiHCl
3(g)+H
2(g)△H=-210kJ/mol
(ii)Si(s)+4HCl(g)═SiCl
4(g)+2H
2(g)(副反应)△H=-241kJ/mol
①常温下,SiHCl
3和SiCl
4均为液态化合物,二者互溶且均易水解,则分离二者的最佳方法是______.
②某反应的能量变化如图所示:则该反应的能量变化E=______kJ.
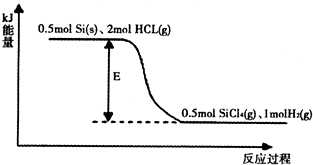
③SiCl
4可转化为SiHCl
3而循环使用,则该反应的热化学方程式为:______.

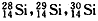 硅的近似相对原子质量为28.1。下列关于
硅的近似相对原子质量为28.1。下列关于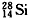 原子含量的
原子含量的