(2013?绍兴一模)绿色化制氢技术是现代能源工业的方向,以CaO为吸收体,将生物质(以C计)与水蒸气反应制取H
2.反应装置由气化炉和燃烧炉两个反应器组成,相关反应如下表所示:
| 流程1:气化炉中产生H2 |
流程2:燃烧炉中CaO再生 |
通入水蒸气,主要化学反应:
①C(s)+H2O(g)=CO(g)+H2(g)
△H=+131.6kJ?mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g)
△H=-41.2kJ?mol-1
③CaO(s)+CO2(g)=CaCO3(s)
△H=-178.3kJ?mol-1 |
通入纯氧,主要化学反应:
④C(s)+O2(g)=CO2(g)
△H=-393.8kJ?mol-1
⑤CaCO3(s)=CaO(s)+CO2(g)
K |
请回答下列问题:
(1)气化炉中总反应:C(s)+2H
2O(g)+CaO(s)=CaCO
3(s)+2H
2(g)△H=
-87.9
-87.9
kJ?mol
-1(2)燃烧炉中反应⑤所需的能量由反应④提供.如果再生1mol CaO,至少需通入纯氧
0.45
0.45
mol.
(3)当只改变温度或压力时,反应⑤有如图所示的变化:
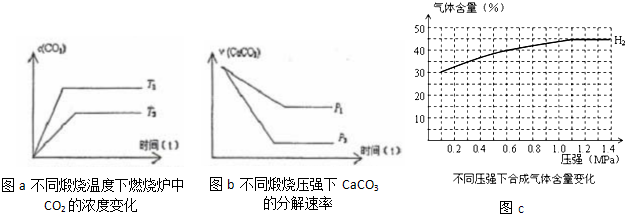
图a推知T
1>
>
T
2(填“>”、“<”、“=”),若温度升高,平衡常数K值
增大
增大
(填“增大”、“减小”、“不变”)
图b推知P
1<
<
P
2(填“>”、“<”、“=”),压强增大,CaCO
3的分解率
减小
减小
(填“增大”、“减小”、“不变”)
(4)在一定温度、不同压力时,气化炉中H
2的变化量约等于CO的变化量(即△n(H
2)=△n(CO)),当起始c(H
2):c(CO)=3:2时,请根据n(H
2)变化,补充完整图C中n(CO)图示变化.
(5)一定条件下,气化炉中的各反应达到平衡状态,采取以下措施可以提高H
2产量的是
BC
BC
(用相关编号填写)
A.反应②中使用合适的催化剂 B.不断移走CaCO
3,并升高气化炉内的温度
C.适当增加水蒸气的通入量 D.增加CaO的量,提高CO
2的吸收率
(6)写出一条这种制H
2技术的优点
实现了吸收剂CaO的循环,降低了能耗;实现了能量自给,符合节能减排等
实现了吸收剂CaO的循环,降低了能耗;实现了能量自给,符合节能减排等
.

