
题目列表(包括答案和解析)
在热的稀硫酸中溶解了11.4 g FeSO4固体,当加入50 mL 0.5 mol·L-1 KNO3溶液时,其中的Fe2+全部转化成Fe3+,KNO3也完全反应并放出NxOy气体。
(1)推算出x= ;y= 。
(2)配平该反应的方程式:
FeSO4+ KNO3+ H2SO4= K2SO4+ Fe2(SO4)3+  (NxOy)+ H2O(配平时x、y用具体数值表示,物质填在
(NxOy)+ H2O(配平时x、y用具体数值表示,物质填在 中)。
中)。
(3)反应中氧化产物是 。
(4)用双线桥法表示该反应中的电子转移方向和数目: 。
Ⅰ.在一体积为10 L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0,CO和H2O浓度变化如图所示:
CO2(g)+H2(g) ΔH<0,CO和H2O浓度变化如图所示:
(1)0~4 min的平均反应速率v(CO)=________mol/(L·min),反应在第5 min时的平衡常数K=________。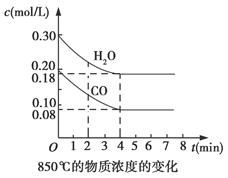
t℃时物质浓度(mol/L)的变化
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0. 200 | 0. 300 | 0 | 0 |
| 2 | 0. 138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0. 116 | 0. 216 | 0. 084 | |
| 6 | 0. 096 | 0. 266 | 0. 104 | |
在热的稀硫酸中溶解了11.4 g FeSO4固体,当加入50 mL 0.5 mol·L-1 KNO3溶液时,其中的Fe2+全部转化成Fe3+,KNO3也完全反应并放出NxOy气体。
(1)推算出x= ;y= 。
(2)配平该反应的方程式:
FeSO4+ KNO3+ H2SO4= K2SO4+ Fe2(SO4)3+  (NxOy)+ H2O(配平时x、y用具体数值表示,物质填在
(NxOy)+ H2O(配平时x、y用具体数值表示,物质填在 中)。
中)。
(3)反应中氧化产物是 。
(4)用双线桥法表示该反应中的电子转移方向和数目: 。
A.N2O B.NO C.N2O3 D.NO2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com