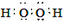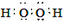A、B、C、D、E都是短周期元素,原子序数依次增大,五种元素核电荷总数为42,B、C同周期,A、D同主族.A、B能形成两种液态化合物甲和乙,原子个数比分别为2:1和1:1.根据以上信息回答下列问题:
(1)甲、乙两分子中含有非极性共价键的物质的电子式是
,C元素在周期表中的位置是
第二周期、第ⅦA族
第二周期、第ⅦA族
.
(2)C和D的离子中,半径较小的是
Na+
Na+
(填离子符号).
(3)将D的单质投入甲中,待D消失后再向上述溶液中加入E的单质,此时发生反应的化学方程式是
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
.
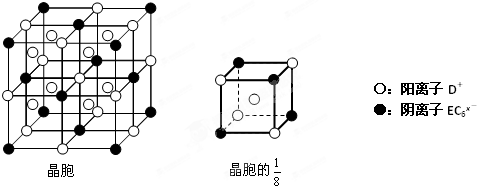
(4)C、D、E可组成离子化合物D
xEC
6,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示,阳离子D
+(用○表示)位于正方体的棱的中点和正方体内部;阴离子EC
6x-(用●表示)位于该正方体的顶点和面心.该化合物的化学式是
Na3AlF6
Na3AlF6
.