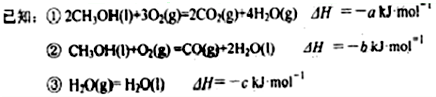CO
2是生活中常见的化合物之一,随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,人类对CO
2的性质研究和综合利用日益重视。
Ⅰ.在催化剂作用下,可由甲醇和CO
2直接合成碳酸二甲酯(DMC):CO
2 + 2CH
3OH → CO(OCH
3)
2 + H
2O,但甲醇转化率通常不会超过1%,这是制约该反应走向工业化的主要原因。某研究小组在其他条件不变的情况下,通过研究温度、反应时间、催化剂用量分别对转化数(TON)的影响来评价催化剂的催化效果。计算公式为:TON=转化的甲醇的物质的量/催化剂的物质的量。
(1)根据反应温度对TON的影响图(相同时间内测定),判断该反应的焓变△H________0(填“>”、“=”或“<”),理由是____________________________________。
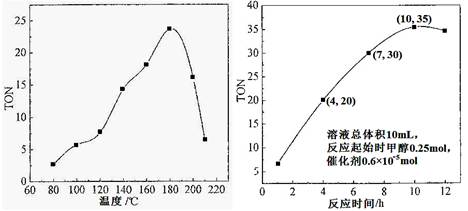
(2)根据反应时间对TON的影响图(上图),已知溶液总体积10mL,反应起始时甲醇0.25mol,催化剂0.6×10
—5 mol,计算该温度下,4~7 h内DMC的平均反应速率:________。
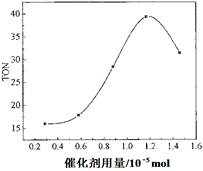
(3)根据该研究小组的实验及催化剂用量对TON的影响图(见上右图),判断下列说法正确的是
。
A.由甲醇和CO
2直接合成DMC,可以利用甲醇把影响环境的温室气体CO
2 转化为资源,在资源循环利用和环境保护方面都具有重要意义
B. 在反应体系中添加合适的脱水剂,将提高该反应的TON
C. 当催化剂用量低于1.2×10
—5 mol时,随着催化剂用量的增加,甲醇的平衡转化率显著提高
D. 当催化剂用量高于1.2×10
—5 mol时,随着催化剂用量的增加DMC的产率反而急剧下降
Ⅱ.如果人体内的CO
2不能顺利排除体外会造成酸中毒,缓冲溶液可以抵御外来少量酸或碱对溶液pH的影响,人体血液里主要通过碳酸氢盐缓冲体系(H
2CO
3/HCO
3-)维持pH稳定。己知正常人体血液在正常体温时,H
2CO
3的一级电离常数Ka
1=10
-6.1,c(HCO
3-):c(H
2CO
3)≈20:1,lg2=0.3。
(4)由题给数据可算得正常人体血液的pH________(保留一位小数)。
(5)正常人体血液中H
2CO
3、HCO
3-、OH
-、H
+四种微粒浓度由大到小关系为:
。
(6)当少量的酸、碱进入血液中时,血液pH变化不大,其原因是
。