
题目列表(包括答案和解析)
 2NH3是工业上合成氨的重要反应.
2NH3是工业上合成氨的重要反应.
 2NH3(g)△H=2(E1-E3)或-2(E3-E1)kg/mol
2NH3(g)△H=2(E1-E3)或-2(E3-E1)kg/mol 2NH3(g)△H=2(E1-E3)或-2(E3-E1)kg/mol
2NH3(g)△H=2(E1-E3)或-2(E3-E1)kg/mol| 16 |
| a2 |
| 16 |
| a2 |

| 16 |
| a2 |
| 16 |
| a2 |
表示反应N2(g)+3H2(g)![]() 2NH3(g)(正反应为放热反应)在某一时间段内反应速率与反应过程的曲线关系图,则氨的体积分数最高的一段时间是( )
2NH3(g)(正反应为放热反应)在某一时间段内反应速率与反应过程的曲线关系图,则氨的体积分数最高的一段时间是( )
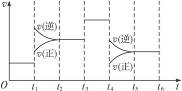
A.t0—t1 B.t2—t3 C.t3—t4 D.t5—t6
可逆反应N2+3H2 2NH3是工业上合成氨的重要反应。
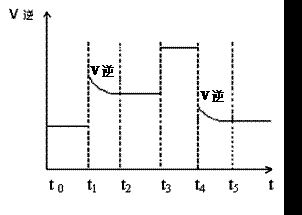
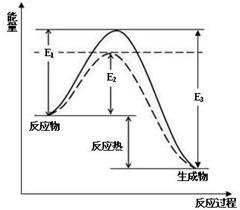
图1 (图中表示生成1mol物质时的能量) 图2
(1)根据图1请写出合成氨的热化学方程式 (热量用E1、E2或E3表示)
(2) 图1中虚线部分是通过改变化学反应中的 条件,请解释原因
(3)当反应达到平衡位置时不断改变条件(不改变N2、H2和NH3的量),图2表示反应速率与反应过程的关系,其中表示平衡混合物中NH3的含量最高的一段时间是
(4)在一定温度下,若将4a mol H2和2amol N2放入2L的密闭容器中,充分反应后测得N2的转化率为50%,则该反应的平衡常数为 。若此时再向该容器中投入a mol H2、amol N2和2amol NH3,判断平衡移动的方向是 (“正向移动”“ 逆向移动”或“不移动”)
(5)将上述实验中产生的NH3通入到0.04mol·L-1的FeCl3溶液中,要使溶液中Fe3+沉淀较完全(即Fe3+浓度降至原来的千分之一),则溶液的pH为 (已知常温下,Fe(OH)3的溶度积常数Ksp=4×10-38)

(1)正反应是______________(填“放热”或“吸热”)反应。
(2)t<500℃时,NH3%逐渐增大,是因为__________________________________________。
(3)t>500℃时,NH3%逐渐减小,是因为__________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com