
题目列表(包括答案和解析)
(1)试说明回收铝的过程中存在的困难。
(2)为什么金的回收率比铝的回收率要大得多?
(3)常温下,SiO2同强碱或强酸是很难反应的,现利用盐酸、氢氧化钠溶液、氮气、二氧化碳和水,从铝土矿中提取纯净的Al2O3。试设计一个适用于工业生产上提纯Al2O3的实验方案,用化学方程式表示提纯的过程。
(4)制取1 mol Al理论上需要多少库仑的电量?
(5)假定用6V的直流电源进行电解,制2.7吨铝需要多少千焦的电能?(请列式并计算)
(6)在1.01×105Pa,
(7)如果每度电的费用为0.60元,试计算生产厂家每生产1吨铝需付出的电费为多少元?(1度电=3 600 kJ)(请列式计算)
铝可以从铝土矿中获取,铝土矿是不纯净的铝的氧化物(杂质为Fe2O3和SiO2),它是非再生资源.假如我们对铝的消费保持现有速度,我们能获得生产足够的铝所需的铝土矿仅能维持30年左右.由此看来,保护现有自然资源和对非再生资源的再利用,是值得我们考虑的.但是在废物回收过程中,仍有相当大的难度,其关键的因素主要涉及旧金属的收集与其他废物的分离、回收和提炼金属的费用、金属本身的价值等(已知1 mol电子电量荷约为105 C).
(1)试说明回收铝的过程中存在的困难.
(2)为什么金的回收率比铝的回收率要大得多?
(3)常温下,SiO2同强碱或强酸是很难反应的,现利用盐酸、氢氧化钠溶液、氮气、二氧化碳和水,从铝土矿中提取纯净的Al2O3.试设计一个适用于工业生产上提纯Al2O3的实验方案,用化学方程式表示提纯的过程.
(4)制取1 mol Al理论上需要多少库仑的电荷量?
(5)假定用6 V的直流电源进行电解,制2.7吨铝需要多少千焦的电能?(请列式并计算)
(6)在1.01×105 Pa,27℃时,每生产1 mol Al,理论上在阳极生成O2的体积为多少升?(请列式并计算)
(7)如果每度电的费用为0.60元,试计算生产厂家每生产1吨铝需付出的电费为多少元.(1度电=3600 kJ)(请列式计算)
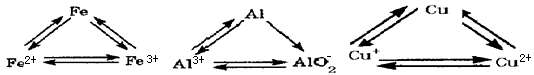



铝可以从铝土矿中获取。铝土矿是不纯净的铝的氧化物(杂质为Fe2O3和SiO2),它是非再生资源。假如对铝的消费保持现有的速度,获得生产足够的铝所需的铝土矿仅能维持30年左右。由此看来,保护现有自然资源和对非再生资源的再利用,是值得考虑的。但废物回收有相当大的难度,其关键因素主要涉及旧金属的收集,与其他废物的分离、回收和提炼金属的费用,金属本身的价值等。(已知1 mol电子电量约为
(1)试说明回收铝的过程中存在的困难。
(2)为什么金的回收率比铝的回收率要大得多?
(3)常温下,SiO2与强碱或强酸是很难反应的。现利用盐酸、氢氧化钠溶液、氨气、二氧化碳和水,从铝土矿中提取纯净的Al2O3。试设计一个适用于工业Al2O3的实验方案。用化学方程式表示提纯的过程。
(4)制取1 mol Al需要多少库仑的电量?
(5)假定用6 V直流电源供电进行电解,制2.7 t Al需要多少千焦的电能?(请列式并计算)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com