
题目列表(包括答案和解析)
| X | Y | |
| 第一电离能(KJ/mol) | 495.8 | 418.8 |
茶叶中含有咖啡因和单宁等多种物质。咖啡因有弱碱性,又叫咖啡碱;单宁有弱酸性,又叫单宁酸。咖啡因既是天然的食品添加剂,又是制药工业的重要原料,从茶叶中提取咖啡因具有重要的意义。咖啡因的溶解性状况如下表。
|
溶剂 |
沸水(100 ℃) |
热水(80 ℃) |
水(25 ℃) |
热乙醇(60 ℃) |
乙醇(25 ℃) |
氯仿(25 ℃) |
乙醚(25 ℃) |
|
溶解度/g |
66.6 |
18.2 |
2 |
4.5 |
2 |
18.2 |
0.19 |
单宁酸能溶于水、乙醇、丙酮和甘油,几乎不溶于乙醚、苯、氯仿和石油醚。
(1)从茶叶中浸取咖啡因,下列溶液中最好的是________(填字母代号),这样选择的理由是________________________________________________________________________
________________________________________________________________________。
A.热乙醇 B.沸水 C.乙醇与乙醚的混合物
(2)用所选择的溶剂浸取的咖啡因溶液里含有的主要杂质是__________。
(3)从澄清的茶叶浸取液中提取不带结晶水的咖啡因或带结晶水的咖啡因,都需要有一个合理的实验方案和操作步骤。请从下列项目中选取,先组成提取不带结晶水的咖啡因的实验操作步骤:______________,再组成提取带结晶水咖啡因的实验操作步骤:______________。(填序号)
①蒸发浓缩 ②焙烧 ③加石灰、蒸干 ④升华 ⑤过滤 ⑥冷却结晶
空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
(1)溴在周期表中位于 周期 族。
(2)步骤①中用硫酸酸化可提高Cl2的利用率,理由是
(3)步骤④利用了SO2的还原性,反应的离子方程式为
(4)步骤⑥的蒸馏过程中,温度应控制在80~90 ℃,温度过高或过低都不利于生产,请解释原因 。
(5)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的密度相差很大的特点进行分离。分离仪器的名称是 。
(6)步骤①、②之后并未直接用“含Br2的海水”进行蒸馏得到液溴,而是经过“空气吹出”“SO2吸收”“氧化”后再蒸馏,这样操作的意义是 。
(共12分) 工业上以锂辉石(Li2O·Al2O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:
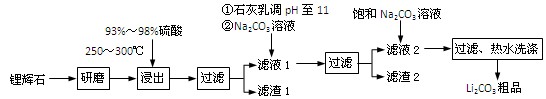
已知:① Li2O·Al2O3·4SiO2 H2SO4(浓)
H2SO4(浓) Li2SO4
Li2SO4 Al2O3·4SiO2·H2O↓
Al2O3·4SiO2·H2O↓
② 某些物质的溶解度(S)如下表所示:
|
T/℃ |
20 |
40 |
60 |
80 |
|
|
1.33 |
1.17 |
1.01 |
0.85 |
|
|
34.2 |
32.8 |
31.9 |
30.7 |
③ 从滤渣1中分离出Al2O3的部分流程如下图所示:

(1)、请依次写出在括号内加入试剂的化学式 、 。
(2)、请依次写出方框中所得到物质的化学式 、 。
(3)、步骤Ⅰ中反应的离子方程式是 。
(4)、已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述) 。
(5)、向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是
。
(6)、氧化铝在工业上用作高温耐火材料,制耐火砖、坩埚、瓷器、人造宝石等,同时氧化铝也是炼铝的原料。写出用氧化铝炼铝的化学方程式: 。
(共16分) 硫化钠是用于皮革鞣制的重要化学试剂,可用无水芒硝(Na2SO4)与炭粉在高温下反应而制得,反应式如下:
① Na2SO4 4C
4C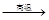 Na2S
Na2S 4CO↑
4CO↑
② Na2SO4 4CO
4CO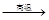 Na2S
Na2S 4CO2
4CO2
(1)、现要制取Na2S 7.80 g,若生产过程中无水芒硝(Na2SO4)的利用率为90%,则理论上需要无水芒硝(Na2SO4) g(精确到0.01);
(2)、若在反应中生成的Na2S物质的量为1 mol,则消耗的碳单质的物质的量n的范围是
<n< ;
(3)、若在上述反应中消耗的碳单质为1 mol,生成Na2S的物质的量为 y mol,生成的CO和CO2的物质的量之比为x,则y与x的关系式为y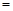 ;
;
(4)、Na2S放置在空气中,会缓慢氧化成Na2SO3及Na2SO4,现称取已经部分氧化的硫化钠样品39.20 g溶于水中,加入足量硫酸,充分反应后,过滤得沉淀9.6 g,放出H2S气体1.12 L(标准状况)。请计算:39.20 g样品中各成分的物质的量分别为 。
(请写出计算过程)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com