
题目列表(包括答案和解析)
在最原始的大气中,含有大量的CO2但几乎不含有O2。而在当今的大气中却含有近21%的氧气,而CO2的含量却很少。请你结合所学知识推测产生以上变化的原因是
A.大量的火山喷发
B.远古时代绿色植物的光合作用
C.强紫外线使水分解而释放出O2和H2
D.火山熔岩流入水体中,使水在高温下分解
(1)目前上海大部分居民所使用的燃料主要是管道煤气,浦东新区居民开始使用天然气作为民用燃料。管道煤气的主要成分是CO、H2和少量烃类,天然气的主要成分是CH4。它们的燃烧反应如下:
2CO+O2![]() 2CO2
2CO2
2H2+O2![]() 2H2O
2H2O
CH4+2O2![]() CO2+2H2O
CO2+2H2O
根据以上化学方程式判断:燃烧相同量的管道煤气和天然气,消耗空气体积较大的是___________。因此燃烧管道煤气的灶具如改燃天然气,灶具的改进方法是___________进风口(填“增大”或“减小”),如不作改进可能产生的不良后果是_________________________。
管道煤气中含有的烃类,除甲烷外,还有少量的乙烷、丙烷、丁烷等,它们的某些性质见下表:
| 乙烷 | 丙烷 | 丁烷 |
熔点/℃ | -183.3 | -189.7 | -138.4 |
沸点/℃ | -88.6 | -42.1 | -0.5 |
试根据以上某个关键数据解释严寒的冬季管道煤气火焰很小,并呈现持续状态的原因是______________________。
(2)为解决能源危机,人类还需要进一步开发可再生能源,包括太阳能、风能、潮汐能、生物质能等各类能源。生物质包括农、林、畜牧业的废弃物、藻类等,蕴藏着相当惊人的能量。生物质能是绿色植物通过光合作用的光反应阶段,将太阳能转变为_________贮于_________和ADP中。通过暗反应阶段最终将能量贮藏在_________中。利用生物质能还可以极大地减少CO2的排放,有利于解决能源消耗带来的_________效应问题。
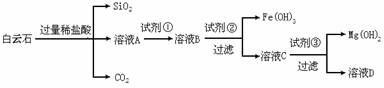
白云石的主要成分为CaCO3·MgCO3,还含有少量Fe、Si的化合物。实验室以白云石为原料制备Mg(OH)2及CaCO3。步骤如下:

实验过程中需要的数据见下表:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Mg2+ | 9.5 | 11.0 |
请回答下列问题:
(1)溶液A中含有Ca2+、Mg2+、Fe2+、Fe3+,则试剂①可选择_________(填字母,下同);试剂②可选择_________;试剂③可选择_________。
(A)KMnO4(B)Cl2(C)MgO(D)CaO
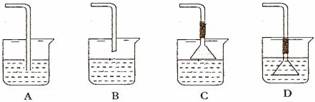
(2)若要利用反应过程中生成的CO2,从溶液D中制取CaCO3,需要先通入的一种气体是_______,然后通入CO2。通入CO2气体应选择的最佳装置为_______(填字母)。

(3)根据表中提供的数据判断,Fe(OH)3、Fe(OH)2和Mg(OH)2的溶度积常数由小到大的排列顺序为________________________________。
(4)将制取的Mg(OH)2煅烧得到MgO,然后在还原炉(真空)中,1200℃条件下,用硅铁(铁不参与反应)还原生成镁蒸气。在还原过程中反应温度对生成金属镁的影响如下图:

煅烧Mg(OH)2所需要的仪器除三角架、酒精灯外,还必须选择___________。MgO与硅铁发生的反应达到平衡后,平衡常数表达式为_______________________。由图可知,还原反应的△H ____0(填“>”或“<”)。
白云石的主要成分为CaCO3·MgCO3,还含有少量Fe、Si的化合物。实验室以白云石为原料制备Mg(OH)2及CaCO3。步骤如下:
实验过程中需要的数据见下表:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Mg2+ | 9.5 | 11.0 |
请回答下列问题:
(1)溶液A中含有Ca2+、Mg2+、Fe2+、Fe3+,则试剂①可选择_________(填字母,下同);试剂②可选择_________;试剂③可选择_________。
(A)KMnO4(B)Cl2(C)MgO(D)CaO
(2)若要利用反应过程中生成的CO2,从溶液D中制取CaCO3,需要先通入的一种气体是_______,然后通入CO2。通入CO2气体应选择的最佳装置为_______(填字母)。
(3)根据表中提供的数据判断,Fe(OH)3、Fe(OH)2和Mg(OH)2的溶度积常数由小到大的排列顺序为________________________________。
(4)将制取的Mg(OH)2煅烧得到MgO,然后在还原炉(真空)中,1200℃条件下,用硅铁(铁不参与反应)还原生成镁蒸气。在还原过程中反应温度对生成金属镁的影响如下图:
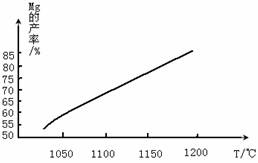
煅烧Mg(OH)2所需要的仪器除三角架、酒精灯外,还必须选择___________。MgO与硅铁发生的反应达到平衡后,平衡常数表达式为_______________________。由图可知,还原反应的△H ____0(填“>”或“<”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com