
题目列表(包括答案和解析)
计算Ag2CrO4在0.001mol?L-1 AgNO3溶液中的溶解度(mol?L-1)
已知: K= 9×10-12
 Ag++Cl-,Ag2CrO4(s)
Ag++Cl-,Ag2CrO4(s)  2Ag++CrO42-.在一定温度下,已知:Ksp(AgCl)=c(Ag+)?c(Cl-)=1.8×10-10,Ksp(Ag2CrO4)=[c(Ag+)]2?c(+CrO42-)=1.9×10-12,现用0.01mol?L-1 AgNO3溶液滴定0.01mol?L-1 KCl和0.001mol?L-1 K2CrO4混合溶液,通过计算回答:
2Ag++CrO42-.在一定温度下,已知:Ksp(AgCl)=c(Ag+)?c(Cl-)=1.8×10-10,Ksp(Ag2CrO4)=[c(Ag+)]2?c(+CrO42-)=1.9×10-12,现用0.01mol?L-1 AgNO3溶液滴定0.01mol?L-1 KCl和0.001mol?L-1 K2CrO4混合溶液,通过计算回答:

 Ag(sq)+Cl(aq),
Ag(sq)+Cl(aq),  2Ag(aq)+CrO42-(aq),一定温度下,其离子浓度乘积为常数,这一常数叫溶度积常数,用Ksp表示,已知:
2Ag(aq)+CrO42-(aq),一定温度下,其离子浓度乘积为常数,这一常数叫溶度积常数,用Ksp表示,已知: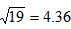 )
) AgCl(固)![]() Ag++Cl-,Ag2CrO4(固)
Ag++Cl-,Ag2CrO4(固)![]() 2Ag++
2Ag++![]() ,在一定温度下,难溶化合物得饱和溶液的离子浓度的乘积为一常数,这个常数用Ksp表示。
,在一定温度下,难溶化合物得饱和溶液的离子浓度的乘积为一常数,这个常数用Ksp表示。
已知:Ksp(AgCl)=c(Ag+)c(Cl-)=1.8×10-10
Ksp(Ag2CrO4)={c(Ag+)}![]() )=1.9×10-12
)=1.9×10-12
现有0.001mol/L AgNO3溶液滴定0.001mol/LKCl和0.001mol/L的K2CrO4的混和溶液,试通过计算回答:
(1)Cl-和![]() 中哪种先沉淀?
中哪种先沉淀?
(2)当![]() 以Ag2CrO4形式沉淀时,溶液中的Cl-离子浓度是多少?
以Ag2CrO4形式沉淀时,溶液中的Cl-离子浓度是多少?![]() 与Cl-能否达到有效的分离?(设当一种离子开始沉淀,另一种离子浓度小于10-5mol/L时,则认为可以达到有效分离)
与Cl-能否达到有效的分离?(设当一种离子开始沉淀,另一种离子浓度小于10-5mol/L时,则认为可以达到有效分离)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com