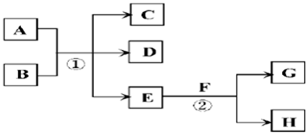
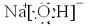(2013?浙江模拟)在下列各变化中,E为常温下无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已省略).
回答下列问题:
(1)写出H的电子式:
(2)若反应①在加热条件下进行,A为单质,C为无色有刺激性气味的气体,D为无色无味的气体,且C、D两种气体均能使澄清的石灰水变浑浊,则反应①的化学方程式是
C+2H
2SO
4(浓)
CO
2↑+SO
2↑+2H
2O
C+2H
2SO
4(浓)
CO
2↑+SO
2↑+2H
2O
.
①实验需要检验出C、D、E三种气体产物,三种气体检验的先后顺序是
H2O SO2 CO2
H2O SO2 CO2
(用化学式填空),在检验D气体前,需除去C气体,所用试剂是
酸性KMnO4溶液
酸性KMnO4溶液
,反应的离子方程式是
2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+
2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+
.
②已知:A(s)+O
2(g)=AO
2(g)△H=-393.5kJ?mol
-12A(s)+O
2(g)=2AO(g)△H=-221.0kJ?mol
-1则AO的燃烧热的热化学方程式
CO(g)+
O
2(g)=CO2(g)△H=-283.0KJ/mol
CO(g)+
O
2(g)=CO2(g)△H=-283.0KJ/mol
.
③AO
2在自然界循环时可与碳酸钙反应,碳酸钙是一种难溶物质,它的K
sp=2.8×10
-9.CaCl
2溶液与Na
2CO
3溶液混合可形成CaCO
3沉淀,现将等体积的CaCl
2溶液与Na
2CO
3溶液混合,若Na
2CO
3溶液的浓度为2×10
-4mol/L,则生成沉淀所需CaCl
2溶液的最小浓度为
5.6×10-5mol/L
5.6×10-5mol/L
.
(3)若反应①在溶液中进行,A是一种常见一元强碱,B是一种酸式盐,D是一种气体,且B遇盐酸产生能使品红溶液褪色的气体,在加热条件下,当A过量时,反应①的离子方程式是
2OH
-+NH
4++HSO
3-NH
3↑+2H
2O+SO
32-2OH
-+NH
4++HSO
3-NH
3↑+2H
2O+SO
32-.
(4)若反应①在溶液中进行,A是一种强酸,B是一种含有两种金属元素的盐,且B的水溶液显碱性,A、B均由短周期元素组成,当A过量时,C及D均易溶于水,则A过量时反应①的离子方程式是
4H++AlO2-=Al3++2H2O
4H++AlO2-=Al3++2H2O
.

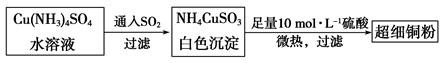
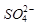 的空间构型为_____________,
的空间构型为_____________,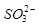 离子中心原子的杂化方式为 。
离子中心原子的杂化方式为 。 ,列式并计算结果)。
,列式并计算结果)。
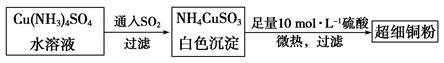
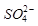 的空间构型为_____________,
的空间构型为_____________, 离子中心原子的杂化方式为 。
离子中心原子的杂化方式为 。 ,列式并计算结果)。
,列式并计算结果)。