
题目列表(包括答案和解析)
(2007,广东, )“碘钟”实验中,
)“碘钟”实验中,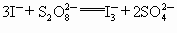 的反应速率可以用
的反应速率可以用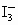 与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如表2-3-2:
与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如表2-3-2:
表2-3-2
|
实验编号 |
① |
② |
③ |
④ |
⑤ |
|
|
0.040 |
0.080 |
0.080 |
0.160 |
0.120 |
|
|
0.040 |
0.040 |
0.080 |
0.020 |
0.040 |
|
t/s |
88.0 |
44.0 |
22.0 |
44.0 |
|
回答下列问题:
(1)该实验的目的是 。
(2)显色时间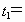 。
。
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间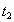 的范围为 (填字母)。
的范围为 (填字母)。
A.<22.0s
B.22.0~44.0s
C.>44.0s
D.数据不足,无法判断
(4)通过分析比较表中数据,得到的结论是 。
(6分)下列说法正确的是 (填序号)。
①由于碘在酒精中的溶解度大,所以可用酒精将碘水中的碘萃取出来
②水的沸点是100℃,酒精的沸点是78.5℃,用直接蒸馏法能使含水酒精变为无水酒精
③由于胶粒的直径比离子大,所以淀粉溶液中混有的碘化钾可用渗析法分离
④分离苯和苯酚的混合液,先加入适量浓溴水,再过滤、分液,即可实现
⑤由于高级脂肪酸钠盐在水中的分散质微粒直径在1nm~100 nm之间,所以可用食盐使高级脂肪酸纳从皂化反应后的混合物中析出
⑥不慎把苯酚溶液沾到皮肤上,应立即用酒精洗涤
⑦用稀溴水滴入苯酚溶液中制备2,4,6-三溴苯酚
⑧实验室使用体积比为1:3的浓硫酸与乙醇的混合溶液制乙烯时,为防加热时反应混合液出现暴沸现象,除了要加沸石外,还应注意缓慢加热让温度慢慢升至170℃
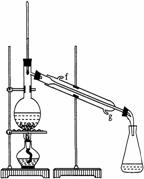
17..(18分)某化学小组采用类似制乙酸乙酯的装置(如右图),以环己醇制备环己烯:
 已知:
已知: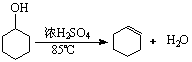
| 密度 | 熔点 | 沸点 | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是 ,
导管B除了导气外还具有的作用是 。
②试管C置于冰水浴中的目的是 。
 (2)制备精品
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和
食盐水,振荡、静置、分层,环己烯在 层(填
“上”或“下”),分液后用 (填入编号)洗涤。
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液
②再将环己烯按右图装置蒸馏,冷却水从 口进入。
蒸馏时要加入生石灰,目的是: 。
③收集产品时,控制的温度应在 左右,实验制得的环己烯精品质量低于理论产量,可能的原因是 ( )
A.蒸馏时从70℃开始收集产品 B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是 ( )
A.用酸性高锰酸钾溶液 B.用金属钠 C.测定沸点
18.(12分)有机
物A的结构简式为![]() ,它可通过不同化学反应分别制得B、C、D和E四种物质。
,它可通过不同化学反应分别制得B、C、D和E四种物质。

请回答下列问题:
(1)指出反应的类型:A→C: 。
(2)在A~E五种物质中,互为同分异构体的是 (填代号)。
(3)写出由A生成B的化学方程式
。
(4)已知HCHO分子中所有原子都在同一平面内,则在上述分子中所有的原子有可能都在同一平面的物质是 (填序号)。
(5)C能形成高聚物,该高聚物的结构简式为 。
(6)写出D与NaOH溶液共热反应的化学方程式
。
19.(16分)肉
桂酸甲酯(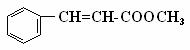 )常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精
)常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精
⑴肉桂酸甲酯的分子式是 ;
 ⑵下列有关肉桂酸甲酯的叙述中,正确的是 填字母);
⑵下列有关肉桂酸甲酯的叙述中,正确的是 填字母);
A.能与溴的四氯化碳溶液发生加成反应
B.无法使酸性高锰酸钾溶液褪色
C.在碱性条件下能发生水解反应
D.不可能发生加聚反应
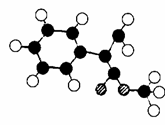
⑶G为肉桂酸甲酯的一种同分异构体,其分子结构模型如右图所示(图中球与球之间连线表示单键或双键)。则G的结构简式为 ;
⑷用芳香烃A为原料合成G的路线如下:

①化合物E中的官能团有 (填名称)。
②F→G的反应类型是 ,该反应的化学方程式为 _ _ 。
③C→D的化学方程式为 _。
④写出符合下列条件的F的同分异构体的结构简式 。O%M
ⅰ.分子内含苯环,且苯环上只有一个支链;
ⅱ.一定条件下,1mol该物质与足量银氨溶液充分反应,生成4mol银单质。
20.(10分)有机物A的蒸汽对同温同压下氢气的相对密度为31,取3.1克A物质在足量氧气中充分燃烧,只生成2.7克水和标准状况下CO22.24L,求有机物的分子式;若该有机物0.2mol恰好与9.2克金属钠完全反应,请写出有机物的结构简式并命名。
(8分)已知:①MnO4— +e- MnO42―(绿色)(强碱性条件)
MnO42―(绿色)(强碱性条件)
②MnO4—+ 8H+ + 5e- Mn2+(无色)+ 4H2O(强酸性条件)
Mn2+(无色)+ 4H2O(强酸性条件)
(1)在KOH溶液中,KMnO4与K2SO3溶液发生反应, 写出反应的离子方程式 。
(2)将KMnO4溶液滴入NaOH溶液微热,得到透明的绿色溶液,写出反应的离子方程式 .
(3)用酸性KMnO4溶液与亚铁盐的反应证明Fe2+具有还原性,MnO4?具有氧化性,最合适的亚铁盐是 (选填编号),可用来酸化KMnO4溶液的试剂是 (选填编号)
a. FeCl2 b. FeSO4 c.Fe(NO3)2 d稀硫酸 e. 盐酸 f. 硝酸
(4)向20 mL浓度为0.05mol/L的KMnO4溶液中滴加FeSO4溶液,使MnO4?全部转化为Mn2+ ,则反应前需向KMnO4溶液加入c(H+)=1mol/L的酸不少于 mL
(8分)已知:①MnO4—
+e- MnO42―
(绿色)(强碱性条件)
MnO42―
(绿色)(强碱性条件)
②MnO4—+ 8H+ + 5e- Mn2+ (无色)+ 4H2O(强酸性条件)
Mn2+ (无色)+ 4H2O(强酸性条件)
(1)在KOH溶液中,KMnO4与K2SO3溶液发生反应, 写出反应的离子方程式 。
(2)将KMnO4溶液滴入NaOH溶液微热,得到透明的绿色溶液,写出反应的离子方程式 .
(3)用酸性KMnO4溶液与亚铁盐的反应证明Fe2+具有还原性,MnO4‑ 具有氧化性,最合适的亚铁盐是 (选填编号),可用来酸化KMnO4溶液的试剂是 (选填编号)
a. FeCl2 b. FeSO4 c.Fe(NO3)2 d稀硫酸 e. 盐酸 f. 硝酸
(4)向20 mL浓度为0.05mol/L的KMnO4溶液中滴加FeSO4溶液,使MnO4‑ 全部转化为Mn2+ ,则反应前需向KMnO4溶液加入c(H+)=1mol/L的酸不少于 mL
 MnO42―(绿色)(强碱性条件)
MnO42―(绿色)(强碱性条件) Mn2+(无色)+ 4H2O(强酸性条件)
Mn2+(无色)+ 4H2O(强酸性条件)湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com