
题目列表(包括答案和解析)
有原子序数A<B<C<D的四种短周期元素,它们均是氨基酸的组成元素.试回答:
(1)表示原子核外电子排布的方法有多种;能最详尽的用化学用语描述C原子核外电子运动状态的表示式是________.
(2)由上述元素中的任意两种元素组成物质X和Y,若已知X分子的空间构型为三角锥形,该分子的电子式为________,Y为天然高分子化合物(限中学教材范围内),其结构简式为________.
(3)由上述元素中的任意三种元素组成的化合物Z,Z属盐类,其溶液呈酸性,Z的化学式为________其水溶液呈酸性的原因是________.
(4)B、C两元素相比较,非金属性较强的是________(填名称),可以验证该结论的实验是________,
(a)这两种元素的单质的稳定性
(b)取同浓度两种元素最高价氧化物对应水化物的溶液,测pH
(c)比较两种元素最高价氧化物在水中的溶解度
(d)将两种元素的气态氢化物通入酸性高锰酸钾溶液中,观察高锰酸钾溶液是否褪色
 短周期元素E、F的离子F+与E2-核外电子排布相同,B、D、E元素的原子序数依次递增,B原子的每个能级上电子数相等,BE2和D2E是等电子体、A是F所在周期非金属性最强的元素,G.E同主族且原子核外电子层数相差两层,
短周期元素E、F的离子F+与E2-核外电子排布相同,B、D、E元素的原子序数依次递增,B原子的每个能级上电子数相等,BE2和D2E是等电子体、A是F所在周期非金属性最强的元素,G.E同主族且原子核外电子层数相差两层,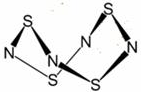 Ⅰ.S4N4的结构如图:
Ⅰ.S4N4的结构如图: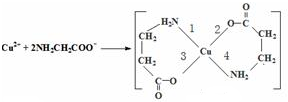
某合金由A、B、C、D 四种元素组成,这四种元素位于周期表中前四周期,A是主要成分元素,A的基态原子中有4个未成对电子。B是第一主要的合金元素,B的含量不低于11%,否则不能生成致密氧化膜BO3防止腐蚀,B与A同周期,且原子核外未成对电子数最多。C位于周期表中第4行、第10列,D的基态原子的最外层电子数是其电子层数的2倍,未成对电子数与电子层数相等。
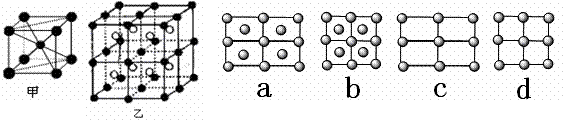
(1)A的原子结构示意图是 。A的一种晶体的晶胞如图甲,乙图中●和○表示的是同种原子,即乙是8个甲无隙并置的结果,若按甲图中虚线方向切乙,得到a~d图中正确的是 。
(2)写出B原子的基态的外围电子排布式_________________,与B同周期且基态原子最外层电子数与B相同的元素,可能位于周期表中的_ __区和 ___区。
(3)基态D原子的外围电子排布图是 。 据报道,只含镁、C和D三种元素的晶体竟然具有超导性。该晶体的结构(如图示)可看作由镁原子和C原子在一起进行面心立方密堆积,该晶体的化学式为 。晶体中每个![]() 原子周围距离最近的
原子周围距离最近的![]() 原子有 个。
原子有 个。
|
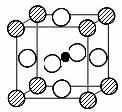
(4)(已知![]() =1.414)CXO晶体晶胞结构为NaCl型,由于晶体缺陷,x值为0.88,晶胞边长为4.28×10-10m。晶胞中两个C原子之间的最短距离为___________m(精确至0.01)。若晶体中的C分别为C2﹢、C3﹢,此晶体中C2﹢与C3﹢的最简整数比为_________。
=1.414)CXO晶体晶胞结构为NaCl型,由于晶体缺陷,x值为0.88,晶胞边长为4.28×10-10m。晶胞中两个C原子之间的最短距离为___________m(精确至0.01)。若晶体中的C分别为C2﹢、C3﹢,此晶体中C2﹢与C3﹢的最简整数比为_________。
Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
元素 | Mn | Fe | |
电离能 /kJ·mol-1 | I1 | 717 | 759 |
I2 | 1 509 | 1 561 | |
I3 | 3 248 | 2 957 | |
回答下列问题:
(1)Mn元素基态原子的价电子排布式为________,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难。对此,你的解释是____________________________________________________________。
(2)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。与Fe原子或离子形成配合物的分子或离子应具备的结构特征是________;②六氰合亚铁离子[Fe(CN)64-]中的配体CN-中C原子的杂化轨道类型是________,写出一种与CN-互为等电子体的单质分子的结构式________。
(3)三氯化铁常温下为固体,熔点282 ℃,沸点315 ℃,在300 ℃以上易升华。据此判断三氯化铁晶体为________。
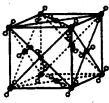
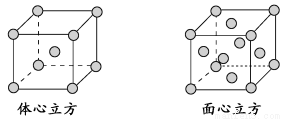
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com