
题目列表(包括答案和解析)
|
下列有关热化学方程式及其叙述正确的是 | |
| [ ] | |
A. |
氢气的燃烧热为285.5 kJ/mo1,则水电解的热化学方程式为: 2H2O(l) |
B. |
1 mol 甲烷完全燃烧生成CO2和H2O(l)时放出890 kJ热量,它的热化学方程式为1/2CH4(g)+O2(g) |
C. |
已知 2C(s)+O2(g) |
D. |
HF 与NaOH溶液反应:H+(aq)+OH-(aq) |
(6分)碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式。
(1) 甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l) △H1= —1214 kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H2= —566 kJ/mol
则表示甲烷燃烧热的热化学方程式 。
(2) 将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。其负极电极反应式是: 。
(3)某同学利用甲烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是 (填序号)
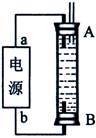
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H+ + 2e-= H2↑
(4)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g)===CO2(g)+H2(g),得到如下三组数据:
|
实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
|
|
H2O |
CO |
CO2 |
|||
|
1 |
650 |
2 |
4 |
1.6 |
5 |
|
2 |
900 |
1 |
2 |
0.4 |
3 |
|
3 |
900 |
1 |
2 |
0.4 |
1 |
①实验1中,以v (H2)表示的平均反应速率为 。
②实验3跟实验2相比,改变的条件可能是 (答一种情况即可)。
下列有关热化学方程式及其叙述正确的是
A.氢气的燃烧热为-285.5kJ/mo1,则水电解的热化学方程式为:
2H2O(1) =2H2(g)+O2(g);△H=+285.5KJ/mo1
B.1mol甲烷完全燃烧生成CO2和H2O(1)时放出890kJ热量,它的热化学方程式为
1/2CH4(g)+O2(g)= 1/2CO2(g)+H2O(1);△H= 一445kJ/mol
C.已知2C(s)+O2(g)=2CO(g);△H= 一221kJ·mol-1,则C的燃烧热为一110.5kJ/mo1
D.HF与NaOH溶液反应:H+(aq)+OH—(aq)=H2O(1);△H= 一57.3kJ/mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com