
题目列表(包括答案和解析)
| |||||||||||||||
| |||||||||||||||
把温度为13℃、浓度为1.0 mol·L-1的酸溶液和1.1 mol·L-1的碱溶液各50 mL混合[溶液密度均为1 g/mL,所生成溶液的比热容c=4.184 J/(g·℃)],轻轻搅动.测得酸碱混合液的温度变化数据如下:

(1)试计算上述两组实验测出的中和热:
ΔH1=________;ΔH2=________.
(2)实验中碱液过量的目的是________.
(3)两组实验结果有差异的原因是________.
(16分)实验室需要0.1 mol·L-1NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是____________(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。
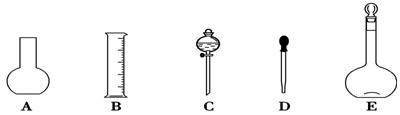
(2)下列是通过使用质量分数为98%(密度为1.84 g·cm-3)的浓硫酸来配制500 mL 0.5 mol·L-1硫酸溶液的操作步骤,其正确的操作顺序是 (填序号)。
A.把容量瓶活塞塞上,反复摇匀后,装贴标签以保存
B.加入蒸馏水进容量瓶中进行定容,待水面离刻度线只有1~2厘米时,采用胶头滴管滴加蒸馏水使其凹液面正好与刻度线相切
C.在烧杯中注入适量的蒸馏水,用量筒准确量取98%的浓硫酸13.3ml慢慢注入烧杯中,并不停地搅拌使之稀释均匀
D.通过计算需要量取98%(密度为1.84 g·cm-3)的浓硫酸13.3ml
E.待烧杯中稀释的硫酸溶液冷却至室温后,通过玻璃棒引流转移至500ml的容量瓶中
F.把玻璃棒和烧杯分别都洗涤2~3次,洗涤液也转移至容量瓶
(3)根据计算用托盘天平称取NaOH的质量为________g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度________0.1 mol·L-1 (填“大于”“等于”或“小于”,下同);若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度________0.1 mol·L-1;溶解NaOH后在未降至室温时,立即将NaOH溶液转移至容量瓶定容,则所得溶液浓度_______ 0.1 mol·L-1。
(4)在容量瓶的使用方法中,下列操作不正确的是 (填写标号).
A.使用容量瓶前检查它是否漏水.
B.容量瓶用蒸馏水洗净后,不需要进行烘干就可以直接使用.
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线1cm~2cm处,用滴管滴加蒸馏水到标线.
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近标线1cm~2cm处,用滴管滴加蒸馏水到标线.
(16分)实验室需要0.1 mol·L-1NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是____________(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。
(2)下列是通过使用质量分数为98%(密度为1.84 g·cm-3)的浓硫酸来配制500 mL 0.5 mol·L-1硫酸溶液的操作步骤,其正确的操作顺序是 (填序号)。
A.把容量瓶活塞塞上,反复摇匀后,装贴标签以保存
B.加入蒸馏水进容量瓶中进行定容,待水面离刻度线只有1~2厘米时,采用胶头滴管滴加蒸馏水使其凹液面正好与刻度线相切
C.在烧杯中注入适量的蒸馏水,用量筒准确量取98%的浓硫酸13.3ml慢慢注入烧杯中,并不停地搅拌使之稀释均匀
D.通过计算需要量取98%(密度为1.84 g·cm-3)的浓硫酸13.3ml
E.待烧杯中稀释的硫酸溶液冷却至室温后,通过玻璃棒引流转移至500ml的容量瓶中
F.把玻璃棒和烧杯分别都洗涤2~3次,洗涤液也转移至容量瓶
(3)根据计算用托盘天平称取NaOH的质量为________g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度________0.1 mol·L-1 (填“大于”“等于”或“小于”,下同);若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度________0.1 mol·L-1;溶解NaOH后在未降至室温时,立即将NaOH溶液转移至容量瓶定容,则所得溶液浓度_______ 0.1 mol·L-1。
(4)在容量瓶的使用方法中,下列操作不正确的是 (填写标号).
A.使用容量瓶前检查它是否漏水.
B.容量瓶用蒸馏水洗净后,不需要进行烘干就可以直接使用.
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线1cm~2cm处,用滴管滴加蒸馏水到标线.
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近标线1cm~2cm处,用滴管滴加蒸馏水到标线.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com