
题目列表(包括答案和解析)
将一定量的CO2缓慢地通入500ml NaOH溶液中,充分反应后将溶液低温蒸发,得到不含结晶水的白色固体A 9.50g。取3份质量不同的A,分别与100ml相同物质的量浓度的盐酸反应,得到的气体体积(标准状况)与A的质量关系如下表所示:( )
|
组别 |
I |
II |
III |
|
盐酸体积/ml |
100 |
100 |
100 |
|
A的质量/g |
1.90 |
3.42 |
3.80 |
|
气体的体积/ml |
448 |
716.8 |
672 |
下列说法不正确的是
A.第I组样品盐酸有剩余
B.若加入0.38g样品,则最终放出气体67.2mL
C.原NaOH的物质的量浓度是0.3mol·L—1
D.盐酸的物质的量浓度的0.5mol/L
(2010?金华模拟)实验测得某同学在活动前后吸入、呼出气体中各种气体的体积百分含量如下表所示.
|
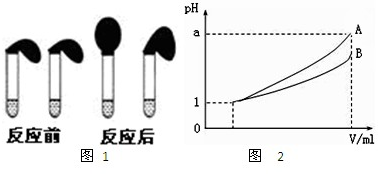
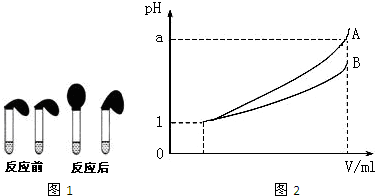 甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动.实验方案如下:
甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动.实验方案如下:| 1 | 25 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com