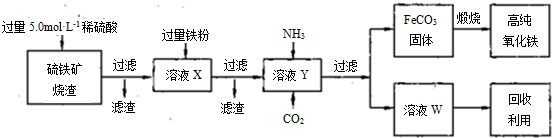
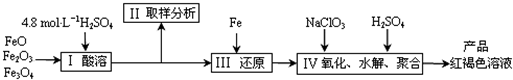
聚合硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理.现用一定质量的铁的氧化物(如下图)为原料来制取聚合硫酸铁,为控制水解时Fe
3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe
3+必须先还原为Fe
2+.实验步骤如下:
(1)实验室用18.4mol?L
-1的浓硫酸配制250mL4.8mol?L
-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种带有刻度的移液管)外,还需
250mL容量瓶、胶头滴管
250mL容量瓶、胶头滴管
.
(2)步骤Ⅱ取样分析溶液中的Fe
2+、Fe
3+的含量,目的是
BC
BC
.
A.控制溶液中Fe
2+与Fe
3+含量比 B.确定下一步还原所需铁的量
C.确定氧化Fe
2+所需NaClO
3的量 D.确保铁的氧化物酸溶完全
(3)写出步骤Ⅳ中用NaClO
3氧化时的离子方程式
6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
(提示:ClO
3-转化为Cl
-);
已知1mol HNO
3的价格为0.16元,1mol NaClO
3的价格为0.45元,评价用HNO
3代替NaClO
3作为氧化剂的利弊,利是
原料成本较低
原料成本较低
,弊是
产生气体对大气有污染
产生气体对大气有污染
.
(4)为了分析产品聚合硫酸铁溶液中SO
42-与Fe
3+物质的量之比,有人设计了以下操作:
(a)取25mL聚合硫酸铁溶液,加入足量的BaCl
2溶液,产生白色沉淀,白色沉淀经过过滤、洗涤、干燥后,称重,其质量为m g.
(b)另取25mL聚合硫酸铁溶液,加足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250mL溶液,取该溶液25.00mL,用KMnO
4酸性溶液滴定,到达终点时用去0.1000mol/L KMnO
4标准溶液VmL.反应的离子方程式为:5Fe
2++MnO
4-+8H
+=5Fe
3++Mn
2++4H
2O
回答下列问题:
①判断(a)步骤溶液中SO
42-离子已沉淀完全的方法是
取上层清夜,滴加BaCl2溶液,若无沉淀产生,则溶液中SO42-已沉淀完全
取上层清夜,滴加BaCl2溶液,若无沉淀产生,则溶液中SO42-已沉淀完全
;
②在(b)步骤中判断达到终点的现象是
溶液由浅蓝色变为浅紫红色,且半分钟内不变色
溶液由浅蓝色变为浅紫红色,且半分钟内不变色
;
③聚合硫酸铁中SO
42-与Fe
3+的物质的量之比为
(用含m、V的代数式表示).