(2013?漳州二模)工业生产纯碱的过程如下:粗盐水
滤液
滤渣
纯碱
完成下列填空:
(1)粗盐水(含杂质离子Mg
2+、Ca
2+),加入沉淀剂A、B除杂质(A来源于石灰窑厂),则沉淀剂B的化学式为
Na2CO3
Na2CO3
.
(2)实验室模拟由滤液制备滤渣的装置如下:
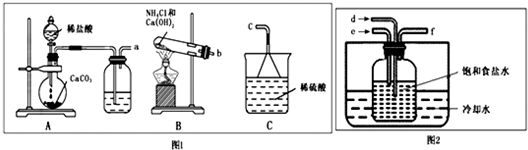
①图1中装置和图2中装置的连接方法为a接
d
d
,b接
e
e
,f接c.
②图2中试剂瓶内发生的化学反应方程式为
NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
.
③实验中要求通入的NH
3过量之后再通入CO
2气体,检验通入的NH
3已过量的实验操作是
用蘸有浓盐酸的玻璃棒靠近管口f,若有白烟生成,说明氨气过量;或用湿润的红色石蕊试纸靠进管口f,若试纸变蓝,说明氨气过量
用蘸有浓盐酸的玻璃棒靠近管口f,若有白烟生成,说明氨气过量;或用湿润的红色石蕊试纸靠进管口f,若试纸变蓝,说明氨气过量
.
(3)操作=5\*MERGEFORMAT ⑤煅烧后的纯碱中含有未分解的碳酸氢钠.某同学称取该纯碱样品m g,再充分加热至质量不再变化时称得剩余固体的质量为n g,则纯碱样品中碳酸钠的质量分数为
.
(4)现有25℃下,0.1mol/LNH
3?H
2O溶液和0.1mol/LNH
4Cl溶液,将两份溶液等体积混合测得溶液的pH=9,下列说法正确的是
cd
cd
(填代号).
A.0.1mol/L NH
4Cl溶液与混合后溶液中导电粒子的种类和数目均相同
b.混合后的溶液中,c(NH
3?H
2O)>c(Cl
-)>c(NH
4+)>c(OH
-)>c(H
+)
c.由题意可知,NH
3?H
2O的电离程度大于同浓度的NH
4Cl的水解程度
d.混合前两份溶液的pH之和大于14.

