
题目列表(包括答案和解析)
| △ |
| △ |
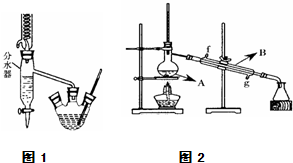 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表.
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表.| 化合物 | 相对分子质量 | 密度/g?cm-3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
(13分)实验室用下列方法测定某水样中O2的含量。
(1)实验原理
用如图所示装置,使溶解在水中的O2在碱性条件下将Mn2+氧化成MnO(OH)2,反应的离子方程式为 。
再用I-将生成的MnO(OH)2再还原为Mn2+,反应的离子方程式为: MnO(OH)2+2I—+4H+=Mn2++I2+3H2O。
然后用Na2S2O3标准溶液滴定生成的I2,反应方程式为:I2+2Na2S2O3=2NaI+Na2S4O6。
(2)实验步骤
① 打开止水夹a 和b,从A 处向装置内鼓入过量N2,此操作的目的是 ;
② 用注射器抽取某水样20.00 mL从A 处注入锥形瓶;
③ 再分别从A 处注入含m mol NaOH溶液及过量的MnSO4溶液;
④ 完成上述操作后,关闭a、b,将锥形瓶中溶液充分振荡;
⑤ 打开止水夹a、b,分别从A 处注人足量NaI溶液及含n mol H2SO4的硫酸溶液;
⑥ 重复④ 的操作。
⑦ 取下锥形瓶,向其中加入2~3滴 作指示剂;
⑧ 用0.005 mol · L—1Na2S2O3滴定至终点。
(3)数据分析
①若滴定过程中消耗的Na2S2O3标准溶液体积为3.90 mL,则此水样中氧(O2)的含量为 (单位:mg·L—1)。
②若未用Na2S2O3标准溶液润洗滴定管,则测得水样中O2的含量将 (填“偏大”、“偏小”或“不变”)。
③实验要求加入适量的H2SO4使溶液接近中性,其原因是 。
表示下列变化的化学用语正确的是
A.溴化亚铁溶液中通入过量氯气:2Fe2++2Br-+3Cl2==2Fe3++Br2+6Cl-
B.实验室用MnO2和浓盐酸制取Cl2:MnO2+4HCl(浓)![]() Mn2++Cl2↑+2Cl-+2H2O C.用FeS除去工业废水中含有的Cu2+:S2-(aq)+Cu2+(aq)=CuS(s)↓
Mn2++Cl2↑+2Cl-+2H2O C.用FeS除去工业废水中含有的Cu2+:S2-(aq)+Cu2+(aq)=CuS(s)↓
D.1L0.5mol·L-1稀硫酸与1L 1mol·L-1氢氧化钠溶液反应放出57.3kJ的热量:
H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(1);△H=-114.6 kJ·mol-1
CaCO3广泛存在于自然界,是一种重要的化工原料。大理石主要成分为CaCO3,另外有少量的含硫化合物(如FeS等)。实验室用大理石和稀盐酸反应制备CO2气体。下列装置可用于CO2气体的提纯和干燥。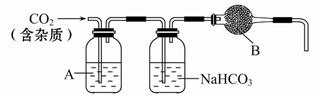
完成下列填空:
(1)用浓盐酸配制1∶1(体积比)的稀盐酸(约6 mol·L-1),应选用的仪器是_____。
a.烧杯 b.玻璃棒 c.量筒 d.容量瓶
(2)上述装置中,A是_____溶液,NaHCO3溶液可以吸收_____。
(3)上述装置中,B物质是_____。把这个实验得到的气体收集起来,用来测定CO2的分子量,如果B物质失效,测定结果_____(填“偏高”、“偏低”或“不受影响”)。
(4)一次性饭盒中石蜡(高级烷烃)和CaCO3在食物中的溶出量是评价饭盒质量的指标之一,测定溶出量的主要实验步骤设计如下:
剪碎、称重→浸泡溶解→过滤→残渣烘干→冷却、称重→恒重,为了将石蜡溶出,应选用的试剂是_____,碳酸钙溶出,应选用的试剂是_____。
a.氯化钠溶液 b.稀醋酸
c.稀硫酸 d.正己烷
(5)在溶出量测定实验中,为了获得石蜡和碳酸钙的最大溶出量,应先溶出_____,原因是_______________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com