(2012?江苏一模)在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.
★乙酸正丁酯的制备
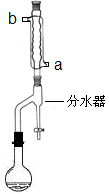
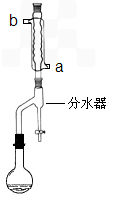
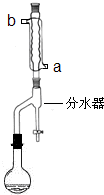
在干燥的50mL圆底烧瓶中,加入11.5mL(0.125mol)正丁醇和7.2mL(0.125mol)冰醋酸,再加入3~4滴浓硫酸,摇匀,投入1~2粒沸石.按图安装带分水器的回流反应装置,并在分水器中预先加入水,使水面略低于分水器的支管口.
打开冷凝水,圆底烧瓶在石棉网上用小火加热.在反应过程中,通过分水器下部的旋塞分出生成的水,注意保持分水器中水层液面原来的高度,使油层尽量回到圆底烧瓶中.反应达到终点后,停止加热,记录分出的水的体积.
★产品的精制
将分水器分出的酯层和反应液一起倒入分液漏斗中,用10mL水洗涤.有机层继续用10mL10%Na
2CO
3洗涤至中性,再用10mL 的水洗涤,最后将有机层倒入锥形瓶中,再用无水硫酸镁干燥.将干燥后的乙酸正丁酯滤入50mL 烧瓶中,常压蒸馏,收集124~126℃的馏分,得11.34g产品.
(1)冷水应该从冷凝管
a
a
(填a或b)管口通入.
(2)判断反应终点的依据是:
分水器中的水层不再增加时,视为反应的终点
分水器中的水层不再增加时,视为反应的终点
.
(3)本实验提高产品产率的方法是
使用分水器分离酯化反应生成的水,使平衡正向移动,提高反应产率
使用分水器分离酯化反应生成的水,使平衡正向移动,提高反应产率
.
(4)产品的精制过程中,第一次水洗的目的是
除去乙酸及少量的正丁醇
除去乙酸及少量的正丁醇
,第二次水洗的目的是
除去溶于酯中的少量无机盐
除去溶于酯中的少量无机盐
.洗涤完成后将有机层从分液漏斗的
上端
上端
置入锥形瓶中.
(5)该实验过程中,生成乙酸正丁酯的产率是
78.4%
78.4%
.

 (2012?江苏一模)在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.
(2012?江苏一模)在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.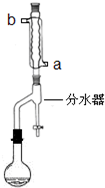 在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.
在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.