
题目列表(包括答案和解析)
(1)从开始反应至达到平衡状态,生成C的平均反应速率为____________。
(2)x=____________。
(3)A的转化率与B的转化率之比为____________。
(4)下列各项可作为该反应达到平衡状态的标志的是____________(填各项代号)
A.压强不再变化 B.气体密度不再变化
C.气体平均相对分子质量不再变化 D.A的消耗速率与B的消耗速率之比为2∶1
(5)若向平衡混合物的容器中再充入2 mol A气体和2 mol B气体,在原温度下达到新的平衡,此时B的物质的量n(B)为____________。
(6)欲使反应达到平衡时C的物质的量分数与上述平衡相等,起始加入的A、B物质的量n(A)、n(B)之间应满足的关系为________________________。
(16分).恒温恒容下,将2 mol A气体和2 mol B气体通入体积为2 L的密闭容器中发生如下反应:2A(g)+B(g) xC(g)+2D(s),2 min时反应达到平衡状态,此时剩余1.2 mol B,并测得C的浓度为1.2 mol·L-1。
xC(g)+2D(s),2 min时反应达到平衡状态,此时剩余1.2 mol B,并测得C的浓度为1.2 mol·L-1。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为______
(2)x=________。
(3)A的转化率为_____ ___。
(4)下列各项可作为该反应达到平衡状态的标志的是________。
| A.压强不再变化 |
| B.气体密度不再变化 |
| C.气体的平均相对分子质量不再变化 |
| D.A的消耗速率与B的消耗速率之比为2∶1 |
 xC(g)+2D(s),2 min时反应达到平衡状态,此时剩余1.2 mol B,并测得C的浓度为1.2 mol·L-1。
xC(g)+2D(s),2 min时反应达到平衡状态,此时剩余1.2 mol B,并测得C的浓度为1.2 mol·L-1。| A.压强不再变化 |
| B.气体密度不再变化 |
| C.气体的平均相对分子质量不再变化 |
| D.A的消耗速率与B的消耗速率之比为2∶1 |
恒温恒容下,将2 mol A气体和2 mol B气体通人体积为2 L的密闭容器中发生如下反应:2A(g)+B(g)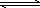 xC(g)+2D(s),2 min时反应达到平衡状态.此时剩余1.2 mol B,并测得C的浓度为1.2 mol·L-1.
xC(g)+2D(s),2 min时反应达到平衡状态.此时剩余1.2 mol B,并测得C的浓度为1.2 mol·L-1.
(1)x=________;
(2)物质A的化学反应速率为________;A的转化率与B的转化率之比为________;
(3)此反应在该温度时的化学平衡常数为________
(4)保持温度和容积不变,向平衡体系中再充入2 mol A和2 mol B气体,达到新平衡时B的物质的量为________:
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com