(2013?上海二模)回答以下关于第三周期元素及其化合物的问题.
(1)Na原子核外共有
11
11
种不同运动状态的电子,有
4
4
种不同能量的电子.
(2)相同压强下,部分元素氟化物的熔点见下表:
| 氟化物 |
NaF |
MgF2 |
SiF4 |
| 熔点/℃ |
1266 |
1534 |
183 |
试解释上表中氟化物熔点差异的原因:
NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低,Mg2+的半径比Na+的半径小,MgF2中离子键更强,熔点更高
NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低,Mg2+的半径比Na+的半径小,MgF2中离子键更强,熔点更高
.
(3)SiF
4分子的空间构型为
正四面体
正四面体
,SiF
4中Si-F键间的键角是
109°28′
109°28′
.
(4)在P、S、C1三种元素形成的氢化物中,热稳定性最大的是
HCl
HCl
(填氢化物的化学式);
(5)已知Na的原子半径大于C1的原子半径,其原因是:
Na、C1电子层数相同,C1的核电荷数更大,核对核外电子的引力更强,原子半径更小
Na、C1电子层数相同,C1的核电荷数更大,核对核外电子的引力更强,原子半径更小
.



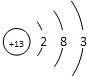
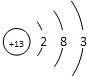
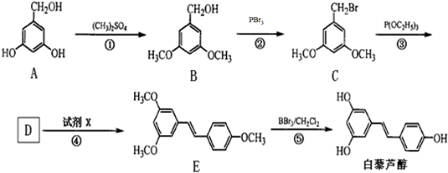
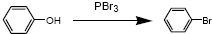
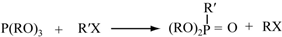
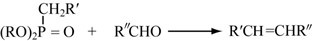 (酮也可发生类似的反应)
(酮也可发生类似的反应)