
题目列表(包括答案和解析)
 按要求填写下列空白.
按要求填写下列空白.按要求填写下列空白
(1)含有一个手性碳原子且式量最小的单烯烃的结构简式 。
(2)若分子式为C4H6的某烃中所有的碳原子都在同一直线上,则该烃的结构简式 _。
(3)烯烃A是2-丁烯的一种同分异构体,它在催化剂作用下与氢气反应的产物不是正丁烷,则A的结构简式为 。
(4)不能使酸性高锰酸钾溶液褪色的相对分子质量最小的苯的同系物的结构简式 _。
(15分)下图是某些常见物质之间的转化关系。A、I是金属单质,F、G是非金属单质。已知B的相对分子质量在75~80之间,E是A的氧化物、其相对分子质量为232。请按要求填写下列空白:
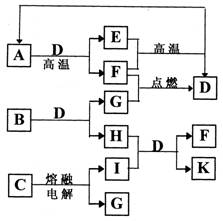
(1)A、B、C代表的物质分别是 , , (填化学式)。
(2)写出B物质的电子式 。
(3)K的水溶液呈碱性,用离子方程式说明其呈碱性的原因 。
(4)写出I→K的离子方程式: 。
(5)当有0.15molA完全反应时,反应中转移电子的物质的量为 。
(14分)铝镁合金已成为飞机制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁4%~6%的铝镁合金(不含其它元素)中镁的质量分数,设计了多种实验方案,其中之一是:将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。按要求填写下列空白:
1.称取5.4g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中。
⑴实验中发生反应的化学方程式是 。
⑵为使其反应完全,则NaOH溶液的体积V ≥ mL。
2.过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将 。
(填“偏高”、“偏低”或“无影响”)。
3. NaOH溶液的浓度可用稀硫酸测定,欲用质量分数98%(密度为1.84 g/cm3)的浓硫酸配制3 mol/L的稀硫酸100 mL。回答下列问题:
⑴需要用量筒量取浓硫酸 mL。
⑵配制操作可分解成如下几步,正确的操作顺序是 。
A.继续往容量瓶中小心地加蒸馏水,使液面接近刻度线1~2cm时。
B.用少量蒸馏水洗涤烧杯及玻璃棒,将溶液注入容量瓶,并重复操作两次。
C.将冷却的稀硫酸转移到容量瓶中。
D.根据计算,用量筒取一定体积的浓硫酸。
E.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌。
F.盖上容量瓶塞子,振荡,摇匀。
G.用胶头滴管加蒸馏水,使溶液凹液面恰好与刻度线相切
⑶下列操作,使制得的稀硫酸溶液浓度偏小的是 (填写编号)。
A.用量筒量取一定液体时,俯视液面读数。
B.在容量瓶定容时俯视刻度线。
C.转移溶液后未洗涤烧杯和玻璃棒。
D.容量瓶刚用蒸馏水洗净,没有烘干。
E.定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切。
(16分)下表是元素周期表的一部分, 针对表中的①~⑩种元素,
按要求填写下列空白:
|
主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
|
2 |
|
|
|
① |
② |
③ |
|
|
|
3 |
④ |
|
⑤ |
⑥ |
|
⑦ |
⑧ |
⑨ |
|
4 |
⑩ |
|
|
|
|
|
|
|
(1) 在这些元素中,化学性质最不活泼的元素是: (填元素符号),其原子结构示意图为 。
(2) 在最高价氧化物的水化物中,酸性最强的化合物的分子式是 ,碱性最强的化合物的电子式是 。
(3) 最高价氧化物属两性氧化物的元素是 (填元素符号);写出它的最高价氧化物与氢氧化钠溶液反应的化学方程式: 。
(4) 用电子式表示元素④与⑦形成的化合物的形成过程: ,
该化合物属于 (填 “共价”或“离子”)化合物。
(5) 比较:氢化物稳定性② ③ ,最高价氧化物对应水化物的酸性② ⑥
(填“>”、“<”或“=”)。
(6) ⑥的最高价氧化物与烧碱溶液反应的离子方程式为 ;
(7) 工业上制取元素⑥的单质的化学方程式为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com