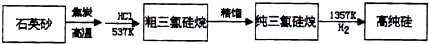
A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,X、Y是生活中常见的金属单质,相关物质间的关系如下图所示.
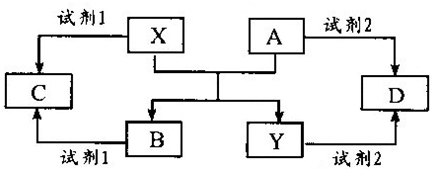
请回答下列问题:
(1)写出X与A反应的化学方程式:
.
(2)若试剂1是NaOH溶液,写出X与试剂1反应的离子方程式
2Al+2H2O+2OH-═2AlO2-+3H2↑
2Al+2H2O+2OH-═2AlO2-+3H2↑
.
(3)若试剂1和试剂2均是稀硫酸.
①检验物质D的溶液中金属离子的方法是
取少量溶液于试管中,滴加几滴KSCN溶液不变色,滴加氯水后溶液变红色,则证明原溶液中含有Fe2+
取少量溶液于试管中,滴加几滴KSCN溶液不变色,滴加氯水后溶液变红色,则证明原溶液中含有Fe2+
.
②将物质C溶于水,其溶液呈酸性,原因是
Al
3++3H
2O

Al(OH)
3+3H
+Al
3++3H
2O

Al(OH)
3+3H
+ (用离子方程式表示).
③某高效净水剂是由Y(OH)SO
4聚合得到的.工业上以D、稀硫酸和亚硝酸钠为原料来制备Y(OH)SO
4,反应中有NO生成,该反应的化学方程式是
2FeSO4+2NaNO2+H2SO4═2Fe(OH)SO4+Na2SO4+2NO↑
2FeSO4+2NaNO2+H2SO4═2Fe(OH)SO4+Na2SO4+2NO↑
.
(4)若试剂1和试剂2均是稀盐酸,将C与D混合后,通入气体Z,再滴加氢氧化钠溶液调节溶液的pH,可水解聚合得到高效净水剂聚合氯化铝铁[AlFe(OH)
nCl
6-n]
m.气体Z是
氯气
氯气
,其作用是
亚铁离子氧化为铁离子
亚铁离子氧化为铁离子
.







 Al(OH)3+3H+
Al(OH)3+3H+ Al(OH)3+3H+
Al(OH)3+3H+