
题目列表(包括答案和解析)
某研究性学习小组利用以下材料来探究NH3的还原性,部分实验装置如下图。
材料1:NH3是强还原剂,能将某些金属氧化物还原为金属单质或低价态的氧化物。如:
 2NH3 + 3CuO
2NH3 + 3CuO ![]() 3Cu + N2 +3H2O
3Cu + N2 +3H2O
材料2:Cu+在酸性溶液中不稳定,可发生自身氧化还原反应生成
Cu2+和Cu:Cu2O + 2H+ == Cu2+ + Cu +H2O
请回答下列问题:
(1)为证明NH3 还原CuO的反应中有水生成,B中应放入的试剂是 。
(2)该小组欲用体积比为1︰4的稀硫酸做试剂,检验反应是否有Cu2O固体生成。现用98%的浓硫酸配制1︰4的稀硫酸,所需的玻璃仪器除了胶头滴管外还有 。 可证明还原产物中含有Cu2O的操作及现象是 。请写出A中生成Cu2O的化学方程式 。
(3)在解决了是否有Cu2O固体生成的问题后,又有同学提出:Cu2O与CuO的热稳定性哪个更强?于是他们进行了如下实验:取98 g Cu(OH)2固体,加热到80℃~100℃时,得到黑色固体粉未,继续加热到1000℃以上,黑色粉未全部变成红色粉未A。冷却后称量,A的质量为72 g。
据此可推得A为 ? ,由此得到的结论是 ? 。
(4)现有8g氧化铜被氨气还原后,得到红色固体6.8g,则红色固体的成份及其物质的量为 ;
若将6.8g上述得到红色固体与足量的稀硫酸充分反应后过滤,可得到固体 g。
镁是很活泼的金属,常用做脱硫剂,脱氧剂。在电子工艺中利用镁制取硅的反应为:2Mg+ SiO2![]() 2MgO+Si,△H=-372kJ•mol-1,同时有副反应:2Mg+Si
2MgO+Si,△H=-372kJ•mol-1,同时有副反应:2Mg+Si![]() Mg2Si发生。Mg2Si遇盐酸迅速反应生成硅烷(SiH4),SiH4常温下是一种不稳定,易分解的气体。
Mg2Si发生。Mg2Si遇盐酸迅速反应生成硅烷(SiH4),SiH4常温下是一种不稳定,易分解的气体。
甲 乙
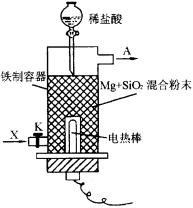
(1)如图甲所示是进行Mg与SiO2反应的实验装置。
①由于O2的存在对该实验有较大影响,实验中应通入X气体作为保护气。X气体应为________(镇标号)。
A.H2 B.N2 C.CO2
②实验开始时必须先通入X气体后,再接通电源加热反应物,其理由是________,当反应引发后,切断电源,反应能继续进行,其理由是________
③反应结束后,待冷却至常温后,关闭K,从分液漏斗处加稀盐酸,可观察到导管口A处有闪亮的火星,据此可推知SiH4的性质________。
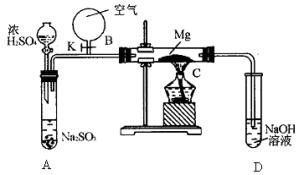
(2)用图乙所示装置的实验如下:先关闭K,使A中反应进行,加热玻璃管C,可观察到C管中发出耀眼白光,产生白烟,管壁上附着有淡黄色物质。实验完成后将C管中固体全部加入盐酸中,有腐蛋味气体生成。
①C中Mg应放在不锈钢垫片上,而不能直接接触试管壁,这是因为________。
②停止实验时,先打开K,再停止滴加浓H2SO4,最后熄灭酒精灯。橡胶气胆B在实验中的作用是________。
③C中全部产物有________(填化学式)。
|
在下图中两个相同的容器中分别充入N2(甲容器中)和NO2(乙容器中),在常温常压下,甲、乙两容器的活塞均停在Ⅰ处(图中虚线部分),当用外力缓慢推活塞到Ⅱ处时,外力对容器所做的功的关系是
| |
| [ ] | |
A. |
W |
B. |
W |
C. |
W |
D. |
无法比较 |

甲 乙
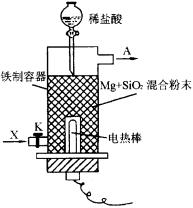
(1)如图甲所示是进行Mg与SiO2反应的实验装置。
①由于O2的存在对该实验有较大影响,实验中应通入X气体作为保护气。X气体应为________(镇标号)。
A.H2 B.N2 C.CO2
②实验开始时必须先通入X气体后,再接通电源加热反应物,其理由是________,当反应引发后,切断电源,反应能继续进行,其理由是________
③反应结束后,待冷却至常温后,关闭K,从分液漏斗处加稀盐酸,可观察到导管口A处有闪亮的火星,据此可推知SiH4的性质________。
(2)用图乙所示装置的实验如下:先关闭K,使A中反应进行,加热玻璃管C,可观察到C管中发出耀眼白光,产生白烟,管壁上附着有淡黄色物质。实验完成后将C管中固体全部加入盐酸中,有腐蛋味气体生成。
①C中Mg应放在不锈钢垫片上,而不能直接接触试管壁,这是因为________。
②停止实验时,先打开K,再停止滴加浓H2SO4,最后熄灭酒精灯。橡胶气胆B在实验中的作用是________。
③C中全部产物有________(填化学式)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com