
题目列表(包括答案和解析)
(8分)现有以下四种溶液;①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液.请回答下列问题:
(1) ②④溶液中由水电离出来的c(H+)的关系是:② ④(填“>”“<”或“=”).
(2) 将②③溶液等体积混合后,溶液的pH 7 (填“>”“<”或“:”). ,
(3)将①④溶液均稀释至原来的10倍后,它们的pH之和 14(填“>”“<”或“=”).
(4)向300 mL溶液④中通入44.8 mL C02(标准状况)气体,充分反应后,溶液中粒子浓度关系正确的是 ( )
A、c(Na+)+ c(H+)=c(OH—)+ c(HCO3—)+ 2c(CO32—)
B、![]() c(Na+)= c(HCO3—)+c(CO32—)+ c(H2CO3)
c(Na+)= c(HCO3—)+c(CO32—)+ c(H2CO3)
C、c(Na+)>c(CO32—)> c(HCO3—)> c(OH—)>c(H+)
D、c(Na+)>c(HCO3—)> c(CO32—)> c(OH—)>c(H+)
【解析】(1)水属于弱电解质,存在电离平衡:H2OH++OH—。所以不论是酸还是碱均是抑制水的电离,②和④中氢离子和OH—的的浓度均相同,抑制水的电离程度是相同的,所以由水电离出来的c(H+)是相同的。
(2)盐酸的浓度是0.01mol/L,氨水是弱电解质,所以其浓度大于0.01mol/L,因此反应后氨水是过量的,溶液显碱性,pH大于7.
(3)。强碱每稀释10n倍,强碱的pH就减小n个单位,所以pH=12的氢氧化钠稀释10倍,pH=11。但醋酸是弱电解质,稀释10倍后溶液的pH将大于3,所以它们的pH之和小于14.
(4)300mlpH=12的氢氧化钠,其物质的量是0.01mol/L×0.3L=0.003mol。44.8 mL C02(标准状况)气体的物质的量是0.002mol,所以二者混合反应后生成物是碳酸钠和碳酸氢钠的混合液,其中二者的物质的量均是0.001mol。CO32-的水解程度大于HCO3-的水解程度,所以选项C错误,D正确。选项A符合电荷守恒,选项B符合物料守恒,均正确。
(8分)现有以下四种溶液;①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液.请回答下列问题:
(1) ②④溶液中由水电离出来的c(H+)的关系是:② ④(填“>”“<”或“=”).
(2) 将②③溶液等体积混合后,溶液的pH 7 (填“>”“<”或“:”). ,
(3)将①④溶液均稀释至原来的10倍后,它们的pH之和 14(填“>”“<”或“=”).
(4)向300 mL溶液④中通入44.8 mL C02(标准状况)气体,充分反应后,溶液中粒子浓度关系正确的是 ( )
A、c(Na+)+ c(H+)= c(OH—)+ c(HCO3—)+ 2c(CO32—)
B、 c(Na+)= c(HCO3—)+
c(CO32—)+ c(H2CO3)
c(Na+)= c(HCO3—)+
c(CO32—)+ c(H2CO3)
C、c(Na+)> c(CO32—)> c(HCO3—)> c(OH—)> c(H+)
D、c(Na+)> c(HCO3—)> c(CO32—)> c(OH—)> c(H+)
【解析】(1)水属于弱电解质,存在电离平衡:H2O H++OH—。所以不论是酸还是碱均是抑制水的电离,②和④中氢离子和OH—的的浓度均相同,抑制水的电离程度是相同的,所以由水电离出来的c(H+)是相同的。
H++OH—。所以不论是酸还是碱均是抑制水的电离,②和④中氢离子和OH—的的浓度均相同,抑制水的电离程度是相同的,所以由水电离出来的c(H+)是相同的。
(2)盐酸的浓度是0.01mol/L,氨水是弱电解质,所以其浓度大于0.01mol/L,因此反应后氨水是过量的,溶液显碱性,pH大于7.
(3)。强碱每稀释10n倍,强碱的pH就减小n个单位,所以pH=12的氢氧化钠稀释10倍,pH=11。但醋酸是弱电解质,稀释10倍后溶液的pH将大于3,所以它们的pH之和小于14.
(4)300mlpH=12的氢氧化钠,其物质的量是0.01mol/L×0.3L=0.003mol。44.8 mL C02(标准状况)气体的物质的量是0.002mol,所以二者混合反应后生成物是碳酸钠和碳酸氢钠的混合液,其中二者的物质的量均是0.001mol。CO32-的水解程度大于HCO3-的水解程度,所以选项C错误,D正确。选项A符合电荷守恒,选项B符合物料守恒,均正确。
今有①CH3COOH、②HCl、③H2SO4三种溶液,试回答下列问题
(1)当它们的物质的量浓度相同时,其pH的由大到小排列是________(用序号回答)
(2)当它们pH相同时,其物质的量浓度的由大到小排列是________(用序号回答)
(3)中和同一烧碱溶液,需同浓度的三种酸溶液的体积依次为:V1、V2、V3,它们的关系为________.(用只含“=”的关系式表示)
下列说法正确的是
①常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4
②为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
③相同温度下,将足量氯化银固体分别放入相同体积的a.蒸馏水 b.0.1 mol·L—1盐酸、
c.0.1 mol·L—1氯化镁溶液 d.0.1 mol·L—1硝酸银溶液中,Ag+浓度:a>d=b>c
④用0.2000 mol·L—1NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1 mol·L—1),至中性时,溶液中的酸未被完全中和
⑤将水加热到120℃,pH=6:c(OH-)< c(H+)
⑥醋酸与醋酸钠的pH=7的混合溶液中:c(CH3COO-)> c(Na+)
⑦0.lmoI·L-1的硫酸铵溶液中:c(NH4+)> c(SO42-)> c(H+)
⑧pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)= c(H+)
| A.③⑤ | B.①⑧ | C.④⑦ | D.②⑥ |
A、B、C、D、E五种溶液分别是NaOH、NH3·H2O、CH3COOH、HCl、NH4HSO4中的一种。常温下进行下列实验:
①将1 L pH=3的A溶液分别与0.001mol·L-1 xL B溶液、0.001mol·L-1 yL D溶液充分反应至中性,x、y大小关系为:y<x;②浓度均为0.1mol·L-1A和E溶液,pH:A<E;③浓度均为0.1mol·L-1C与D溶液等体积混合,溶液呈酸性。
回答下列问题:
(1)D是 溶液,判断理由是 。
(2)用水稀释0.1 mol·L-1B时,溶液中随着水量的增加而减小的是 (填写序号)。
① ②
② ③c(H+)和c(OH-)的乘积
④OH-的物质的量
③c(H+)和c(OH-)的乘积
④OH-的物质的量
(3)OH-浓度相同的等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是________(填写序号)。
①反应所需要的时间E>A ②开始反应时的速率A>E
③参加反应的锌粉物质的量A=E ④反应过程的平均速率E>A
⑤A溶液里有锌粉剩余 ⑥E溶液里有锌粉剩余
(4)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如右图中的_________曲线(填写序号) 。
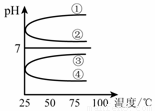
(5)室温下,向0.01mol·L-1 C溶液中滴加0.01mol·L-1 D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为_______________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com