
题目列表(包括答案和解析)
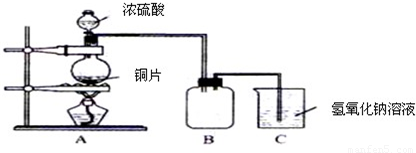
 N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.
N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.| 时间/h | 1 | 2 | 3 | 4 | 5 | |
| c(NO)/mol?L-1 | 1.00×10-3 | 4.5×10-4 | 2.5×10-4 | 1.5×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol?L-1 | 3.6×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
Na、Fe、Cu、Al是常见的金属元素,请按要求回答下列问题:
(1)一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数为______。
(2)向氯化铜溶液中加入一定量的铁粉和铝粉混合物,充分反应后,下列情况可能出现的是______(填编号)。
a.溶液中有Cu2+、Fe2+、Al3+,不溶物为Cu b.溶液中有Fe2+、Al3+,不溶物为Cu、Fe
c.溶液中有Fe3+、Al3+,不溶物为Cu d.溶液中有Fe2+,不溶物为Cu、Al
(3)将一定质量的铁、铝、铜合金,加入lL一定物质的量浓度的硝酸中,合金完全溶解,测得溶液中(忽略溶液体积的变化)c(H+)=0.5mol/L、c(Cu2+)=0.3mol/L、c(Al3+)=0.2mol/L、c(NO3-)=2mol/L,则混合物中铁的质量为______。
(4)铁的某种氧化物的化学式表示为FexO(x<1),已知铁元素在该氧化物中的质量分数为75%,则x=______ (精确至0.01)。
(5)Na-AI/FeS是一种可充电电池,电池中用含Na+导电固体作为电解质,在工作过程中Na+的物质的量保持不变。
①若该正极的电极反应式表示为:2Na++FeS+2e-=Na2S+Fe,则电池的负极反应式可表示为_____;充电时,阳极发生反应的物质是______。
②用该电池作电源,组成如图所示装置,若通电5min时,铜电极质量增加1.08 g,则该电源电极X名称为______。图中装置A、C的pH变化为:A ______、C ______(填“增大”“减小”或“不变”)。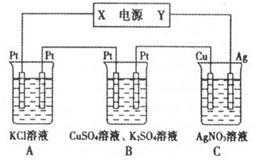
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com