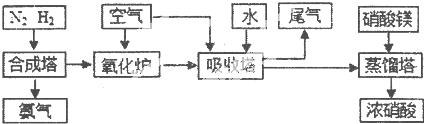
工业合成氨与制备硝酸一般可连续生产,流程如下
(1)①工业生产时,制取氢气的一个反应为:CO+H
2O(g)?CO
2+H
2,850℃时,往1L密闭容器中充入0.3mol CO和0.2molH
2O(g).反应4min后建立平衡,体系中c(H
2)=0.12mol?L
-1.CO的平衡浓度为
0.18mol/L
0.18mol/L
转化率为
40%
40%
该温度下此反应的平衡常数K=
1
1
(填计算结果).
②在850℃时,以表中的物质的量投入恒容反应器中,其中向逆反应方向进行的有
A
A
(选填A、B、C、D、E)
|
A |
B |
C |
D |
E |
| n(CO2) |
3 |
l |
0 |
1 |
l |
| n(H2) |
2 |
l |
0 |
1 |
2 |
| n(CO) |
1 |
2 |
3 |
0.5 |
3 |
| n(H2O) |
5 |
2 |
3 |
2 |
l |
(2)合成塔中发生反应N
2(g)+3H
2(g)?2NH
3(g)△H<0.下表为不同温度下该反应的平衡常数.由此可推知,表中T
1<
<
300℃(填“>”、“<”或“=”).
| T/°C |
T1 |
300 |
T2 |
| K |
1.00×107 |
2.45×105 |
1.88×103 |
(3)N
2和H
2在铁作催化剂作用下从145℃就开始反应,不同温度下NH
3产率图1所示.温度高于900℃时,NH
3产率下降,原因是
900℃时反应达到平衡状态,再升高温度平衡向左移动
900℃时反应达到平衡状态,再升高温度平衡向左移动
.
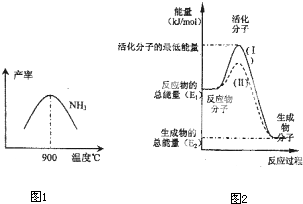
(4)在化学反应中只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ?mol
-1表示.请认真观察图2,回答问题.
图中所示反应是
放热
放热
(填“吸热”或“放热”)反应,该反应的△H=
-(E1-E2)kJ/mol
-(E1-E2)kJ/mol
(用含E
1、E
2E的代数式表示).已知热化学方程式:H
2(g)+
O
2(g)=H
2O(g)△H=-241.8kJ?mol
-1,该反应的活化能为167.2kJ?mol
-1,则其逆反应的活化能为
409kJ/mol
409kJ/mol
.
(5)硝酸厂的尾气直接排放将污染空气.目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
CH
4(g)+4NO
2(g)=4NO(g)+CO
2(g)+2H
2O(g)△H=-574kJ?mol
-1CH
4(g)+4NO(g)=2N
2(g)+CO
2(g)+2H
2O(g)△H=-1160kJ?mol
-1则甲烷直接将NO
2还原为N
2的热化学方程式为:
CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ?mol-1
CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ?mol-1
.

 (g)+3H
(g)+3H (g)
(g) 2NH
2NH (g) △H < 0 ,可以提高氢气的转化率的措施是 ( )
(g) △H < 0 ,可以提高氢气的转化率的措施是 ( ) (g)+3H
(g)+3H (g)
(g) 2NH
2NH (g) △H < 0 ,可以提高氢气的转化率的措施是 ( )
(g) △H < 0 ,可以提高氢气的转化率的措施是 ( )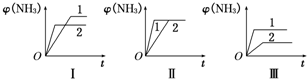
 NH3(g) △H=xkJ/mol。请回答:
NH3(g) △H=xkJ/mol。请回答:


