
题目列表(包括答案和解析)
H2CO3![]() H++
H++![]() ,
,![]()
![]() H++
H++![]() ,若通过某种方式使溶液的pH减小,则c(
,若通过某种方式使溶液的pH减小,则c(![]() )将( )
)将( )
A.增大 B.减小
C.不变 D.可能增大也可能减小
|
在二氧化碳溶于水的平衡体系中,存在以下电离: H2CO3 | |
| [ ] | |
A. |
增大 |
B. |
减小 |
C. |
不变 |
D. |
可能增大也可能减小 |
| ||
| ||
| ||
| 太阳光 |
| ||
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的.
(1)下列措施中,有利于降低大气中的CO2、SO2、NOx浓度的有________(填字母).
a.减少化石燃料的使用,开发新能源
b.使用无氟冰箱,减少氟里昂排放
c.多步行或乘公交车,少用专车或私家车
d.将工业废气用碱液吸收后再排放
(2)脱硝.利用甲烷催化还原NOx:
CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g)+4NO(g)![]() 2N2(g)+CO2(g+2H2O(g) ΔH2=-1160 kJ·mol-1
2N2(g)+CO2(g+2H2O(g) ΔH2=-1160 kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为________.
(3)脱碳.将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH3
CH3OH(g)+H2O(g) ΔH3
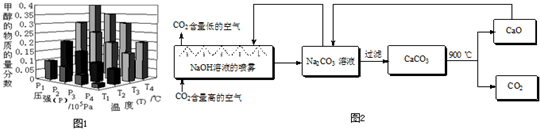
①取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数![]() (CH3OH)与反应温度T的关系曲线如图所示,则上述CO2转化为甲醇的反应的ΔH3________0(填“>”、“<”或“=”).
(CH3OH)与反应温度T的关系曲线如图所示,则上述CO2转化为甲醇的反应的ΔH3________0(填“>”、“<”或“=”).

②在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如下图所示.下列说法正确的是________(填字母代号).

A.第10 min后,向该容器中再充入1 mol CO2和3 mol H2,则再次达到平衡时C(CH3OH)=1.5 mol/L
B.0~10 min内,氢气的平均反应速率为0.075 mol/(L·min)
C.达到平衡时,氢气的转化率为75%
D.该温度下,反应的平衡常数的值为3/16
E.升高温度将使n(CH3OH)/n(CO2)减小
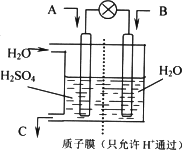
③有学者设想以下图所示装置用电化学原理将CO2转化为重要化工原料.若A为CO2,B为H2,C为CH3OH,则正极电极反应式为________.
(4)脱硫.某种脱硫工艺中将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥.硫酸铵和硝酸铵的水溶液的pH<7,其中原因可用一个离子方程式表示为:________;在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中[Na+]+[H+]________[NO3-]+[OH-](填写“>”“=”或“<”)

 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g) 随时间变化如图所示.下列说法正确的是
随时间变化如图所示.下列说法正确的是 CH3OH(g)+H2O(g)达到平衡状态的是
CH3OH(g)+H2O(g)达到平衡状态的是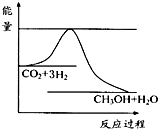
 CH3OH(g)+H2O(g)进行过程中能量(单位为kJ?mol-1)的变化.在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,达到平衡后,采取下列措施中能使c(CH3OH)增大的是
CH3OH(g)+H2O(g)进行过程中能量(单位为kJ?mol-1)的变化.在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,达到平衡后,采取下列措施中能使c(CH3OH)增大的是
 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com