
题目列表(包括答案和解析)
(18分)A、B、C、D、E五种短周期元素,原子序数依次增大。A元素的单质是自然界最轻的气体,E单质须保存在煤油中。A与B、C分别构成电子数相等的化合物M、N,且M是一种能产生温室效应的最简单的有机气体物质;D元素最外层电子数是次外层电子数的3倍;回答下列问题:
(1)N的电子式为 ;M分子中含有 (填“极性”或“非极性”)键
(2)D与E以1:1形成的化合物与水反应的化学反应方程式
(3)A、B、C、D可形成阳离子和阴离子个数比是1∶1的离子化合物X;A、D、E可形成化合物Y;X与Y以物质的量之比1∶2加热反应,写出反应的化学方程式
反应后水溶液显 (填“酸”“碱”或“中”)性,原因是 (用离子方程式表示)
(4)由N与D的单质、KOH溶液构成原电池,负极会产生C的单质。则其负极反应为 ;一段时间后,溶液pH (填“增大”“减小”或“不变”)。
![]() (5)在一定温度下,将4 mol C单质和12 mol A单质通入到体积为2L的密闭容器中,发生反应,2min达到平衡状态时,A单质的转化率是50%,则用A单质表示该反应的平均速率为 ;该温度下的平衡常数为K= 。
(5)在一定温度下,将4 mol C单质和12 mol A单质通入到体积为2L的密闭容器中,发生反应,2min达到平衡状态时,A单质的转化率是50%,则用A单质表示该反应的平均速率为 ;该温度下的平衡常数为K= 。
从化学平衡移动的角度分析,提高A单质的转化率可以采取的措施是 (选填序号字母)。
a、及时分离出生成物 b、平衡后再加入6molA物质 c、增大压强 d、使用催化剂 e、平衡后再加入2molC物质
A、B、D、E和F为中学化学常见的化合物,A、B、D、E的焰色反应均呈黄色,F为无色无味气体。相互转化关系如下:A+F→B+O2 B+F+H2O→D D+E→B+H2O请根据题目要求回答下列问题。
(1)①写出E的电子式 ;
②写出反应A+F→B+O2的化学方程式 ;
③写出D溶液与E溶液反应的离子方程式 。
(2)如图装置(I)为以E为电解质的氢氧燃料电池的示意图。
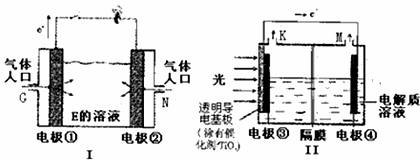
装置(I)中G和N为气体进口,其中G口进入的气体名称是 ,写出电极②的电极反应式 。
(3)装置(II)是新近研制装有涂二氧化钛的光电析的光电电解水装置的示意图,在电极附近的K出口产生气体化学式是 。
(4)在A中加入稀硫酸可生成一种含有非极性键的共价化合物X,写出向E和X的混合溶液中,通入二氧化氮反应的离子方程式 。
A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图所示(部分产物省略)。请按要求回答下列问题:
![]()
(1) 若A是氯碱工业的一种重要产品,通常状况下D是一种非极性气体分子,则D的结构式为 ,A与D以物质的量3:2反应后的溶液中离子浓度的大小顺序为:
(2) 若D为某金属单质,向C的溶液中滴加AgNO3溶液,产生不溶于稀硝酸的白色沉淀,则B的化学式为 ;将B的溶液加热蒸干再灼烧,所得固体物质的化学式为 。
(3) 若D为强电解质溶液,A和k*s*5*uC在溶液中反应生成白色沉淀B,则A和k*s*5*uC反应的离子方程式为 ;符合此条件的D物质可能是 (填序号)
A.H2SO4 B.CH3COOH C. NaOH D.NH3·H2O E.BaCl2
物质A~G有下图所示转化关系(部分反应物、生成物没有列出)。其中A为某金属矿的主要成分,经过一系列反应可得到B和C。单质C可与E的浓溶液发生反应,G为砖红色沉淀。

请回答下列问题:
(1)写出下列物质的化学式:B 、E 、G ;
(2)利用电解可提纯C物质,在该电解反应中阳极物质是 ,阴极物质是 ,电解质溶液是 ;
(3)反应②的化学方程式是 。
(4)将0.23 mol B和0.11 mol氧气放入容积为1 L的密闭容器中,发生反应①,在一定温度下,反应达到平衡,得到0.12 mol D,则反应的平衡常数K= 。若温度不变,再加入0.50 mol氧气后重新达到平衡,则B的平衡浓度 (填“增大”、“不变”或“减小”),氧气的转化率 (填“升高”、“不变”或“降低”),D的体积分数 (填“增大”、“不变”或“减小”)。
(10分)已知A、E、I、L是常见的非金属单质,其中A为淡黄色固体;Z是常见的金属单质,B的相对分子质量比A大32,C的相对分子质量比B大16,Y是一种常见的液体,J是磁性氧化铁,D、H、K均是重要的化工产品;X是结构有待探究的一种新型分子,其组成元素的相对原子质量相差18,下列框图中部分反应条件已略去。
试回答下列问题:
(1)E的结构式为___________,在反应①、②、③、④、⑤、⑥中属于非氧化还原反应的是___________。(填序号)
(2)写出反应②的化学方程式:_________________________________________
(3)若有G、F的混合气体通入足量烧碱溶液,气体全部被吸收,则气体G、F的物质的量之比应满足n(G)︰n(F)____________________
(4)J与过量H的稀溶液反应的离子方程式为___________________________________。
(5)t℃时,将2molE和1mol I通入体积为2L的恒温密闭容器中发生反应,2min后达到平衡n(K)=0.2mol, 此时保持温度不变,体积减半,则E的体积分数如何变化____________(填“增大”、“不变”、“变小”)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com