(2013?重庆模拟)已知X、Y、Z、W、Q都是周期表中短周期的元素,它们的核电荷数依次增大.其中X、Y、Z是同周期的非金属元素.W的三价阳离子与Z的阴离子具有相同的电子层结构,它们相互形成的化合物中存在离子键;XZ
2为非极性分子;Y、Z 氢化物的沸点比它们同族其他元素氢化物的沸点高;Q在同周期元素中原子半径最小.
回答下列问题:
(1)写出化合物XZ
2的电子式
,其晶体类型为
分子晶体
分子晶体
.
(2)Y、Z 氢化物的沸点比它们同族元素氢化物的沸点高的原因是
氨气分子之间、水分子之间都存在氢键
氨气分子之间、水分子之间都存在氢键
.
(3)将少量YZ
2通入过量小苏打溶液中,再使逸出的气体通过装有足量过氧化钠颗粒的干燥管,最后收集到的气体是
二氧化氮、氧气
二氧化氮、氧气
.
(4)某温度下,在2L密闭容器中投入0.2mol H
2和0.2mol XZ
2,发生如下反应:H
2+XZ
2?H
2Z+XZ 测得平衡时,XZ
2的转化率为60%,则该温度下的平衡常数为
2.25
2.25
.
(5)高铁酸钾(K
2FeO
4)是一种新型的高效氧化剂和消毒剂,常用于饮用水处理.工业生产高铁酸钾的方法为:①常温下先将Q的单质通入氢氧化钠溶液中制得含Q元素的一种含氧酸盐;②再将其与氢氧化钠溶液混合氧化硝酸铁,得到高铁酸钠粗产品;③过滤后用氢氧化钾溶液溶解,重结晶,再经过脱碱、洗涤、干燥处理,得到高铁酸钾.写出②中发生反应的离子方程式
3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O
3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O
,第③步中高铁酸钠能够转化为高铁酸钾的原因是
高铁酸钾的溶解度比高铁酸钠的溶解度小
高铁酸钾的溶解度比高铁酸钠的溶解度小
.

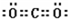
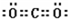
 某温度下,在2L密闭容器中X、Y、Z三种物质(均为气态)间进行反应,其物质
某温度下,在2L密闭容器中X、Y、Z三种物质(均为气态)间进行反应,其物质 3Y+Z
3Y+Z 3Y+Z
3Y+Z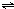 2C(g)达到平衡时,测得A、B、C物质的量之比为2:2:1.若保持温度不变,以2:2:1的物质的量之比再充入A、B、C,下列判断正确的是( )
2C(g)达到平衡时,测得A、B、C物质的量之比为2:2:1.若保持温度不变,以2:2:1的物质的量之比再充入A、B、C,下列判断正确的是( )