
题目列表(包括答案和解析)
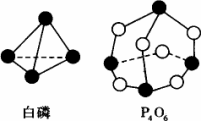
化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1 mol化学键时释放出(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1)P-P:198 P-O:360 O-O:498计算反应P4(白磷)+3O2→P4O6的反应热为________.
PCl5也是一种白色固体,加热到160℃不经过液态阶段就变为蒸气,测得180℃下的蒸气密度(折合成标准状况)为9.3 g·L-1,继续加热到250℃时测得压力为计算值的两倍.PCl5在加压下于148℃液化,形成一种能导电的液体,测得P-Cl的键长为198 pm和206 pm两种.根据以上条件回答下列问题:
(1)PCl5固体是一种什么类型的晶体?180℃下PCl5蒸气中存在什么分子?为什么?
(2)250℃下PCl5蒸气中存在什么分子?为什么?
(3)PCl5熔体为什么导电?用最简洁的形式作出解释?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com