
题目列表(包括答案和解析)
 某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示.由图中数据分析:
某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示.由图中数据分析: 2Z
2Z 2Z
2Z| A、等物质的量的乙二醇和乙醇分别与足量金属钠反应,乙二醇产生的氢气多 | B、乙烯和苯都能和氢气发生加成反应 | C、乙烯可发生加成反应,而乙烷不能 | D、苯酚能与氢氧化钠溶液反应,而乙醇不能 |
| 2 |
| 3 |
c(N
| ||
| c(OH-) |
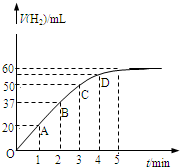 在恒温、恒容的密闭容器中发生如下反应:2HI(g)?H2(g)+I2(g),实验测定,在标准状况下产生氢气的体积和时间的关系如图所示.回答下列问题:
在恒温、恒容的密闭容器中发生如下反应:2HI(g)?H2(g)+I2(g),实验测定,在标准状况下产生氢气的体积和时间的关系如图所示.回答下列问题:湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com