
题目列表(包括答案和解析)
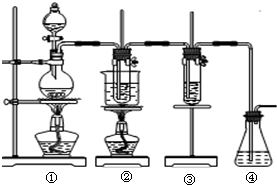
 在实验室里可用右图所示装置制取氯酸钾和探究氯水的性质. 图中:①为氯气发生装置;②的试管里盛有15mL 30%KOH溶液,并置于水浴中;③的试管里加有紫色石蕊试液;④为尾气吸收装置.请填写下列空白:
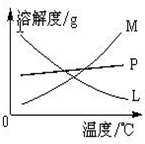
在实验室里可用右图所示装置制取氯酸钾和探究氯水的性质. 图中:①为氯气发生装置;②的试管里盛有15mL 30%KOH溶液,并置于水浴中;③的试管里加有紫色石蕊试液;④为尾气吸收装置.请填写下列空白: 图中符合该晶体溶解度曲线的是______(填写编
图中符合该晶体溶解度曲线的是______(填写编| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为______色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | ______ |
| 然后溶液从无色逐渐变为______色 | ______ |
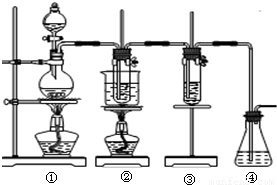
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为______色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | ______ |
| 然后溶液从无色逐渐变为______色 | ______ |
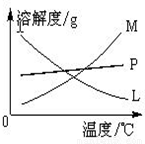
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为______色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | ______ |
| 然后溶液从无色逐渐变为______色 | ______ |
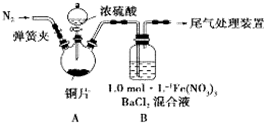 我省从2013年12月1日零时起,车用汽油升级为“国Ⅳ”标准,汽油中的硫含量下降三分之二,对二氧化硫的排放有了大大的改善,SO2可以用Fe( NO3)3溶液吸收,某化学兴趣小组对SO2和 Fe( NO3)3 溶液的反应[0.1mol/L的Fe(NO3)3 溶液的 pH=2]做了相应探究.
我省从2013年12月1日零时起,车用汽油升级为“国Ⅳ”标准,汽油中的硫含量下降三分之二,对二氧化硫的排放有了大大的改善,SO2可以用Fe( NO3)3溶液吸收,某化学兴趣小组对SO2和 Fe( NO3)3 溶液的反应[0.1mol/L的Fe(NO3)3 溶液的 pH=2]做了相应探究.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com