
题目列表(包括答案和解析)
I 实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙。大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤:
(1)用硝酸溶解大理石时通常控制反应温度不超过70℃,且不使用浓硝酸,原因是
、 。
(2)操作Ⅱ的目的是  , 若A为溶液,则A可以是 。
, 若A为溶液,则A可以是 。
(3)写出加入碳酸铵所发生反应的离子方程式:  。
。
II 以硫酸工业的尾气、氨水、石灰石、焦炭及碳酸氢铵和KCl为原料可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质。合成路线如下: 
(4)已知对苯二酚是一种强还原剂。生产中,反应Ⅱ中往往需要向溶液中加入适量的对苯二酚等物质,其目的是 。
(5)下列有关说法正确的是 。
| A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙 |
B.反应Ⅲ中发生反应的化学方程式为:CaSO4+4C CaS +4CO↑ CaS +4CO↑ |
| C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解 |
| D.反应Ⅴ中的副产物氯化铵可用作氮肥 |

 , 若A为溶液,则A可以是 。
, 若A为溶液,则A可以是 。 。
。
| A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙 |
B.反应Ⅲ中发生反应的化学方程式为:CaSO4+4C CaS +4CO↑ CaS +4CO↑ |
| C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解 |
| D.反应Ⅴ中的副产物氯化铵可用作氮肥 |
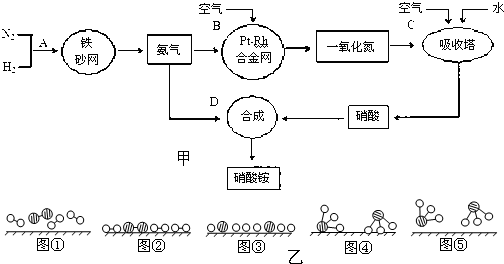
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵,反应的化学方程式如下:2 NH3(g)+CO2(g)  NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0 
(1)实验室制备NH3的化学方程式是: 。
(2)制备氨基甲酸铵的装置如下图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是 。液体石蜡鼓泡瓶的作用是 。
②从反应后的混合物中分离出产品的实验方法是 (填写操作名称)。为了得到干燥产品,应采取的方法是 (填写选项序号)。
a. 常压加热烘干 b. 高压加热烘干 c. 真空40 ℃以下烘干
③尾气处理装置如右图所示。双通玻璃管的作用: ;
浓硫酸的作用: 。
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7825 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000 g。则样品中氨基甲酸铵的物质的量分数为 。
 NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0 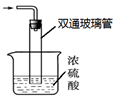

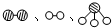 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是______、______.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是______、______.
| ||
| △ |
| 注意事项 | 理由 | |
| ① | ||
| ② |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com