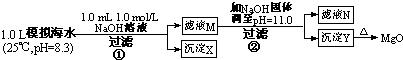
(2011?闵行区二模)天然水由于长期与土壤、岩石等接触,会溶有一定量的Ca
2+、Mg
2+、HCO
3-等,这样的水在加热过程中很容易形成水垢.水垢可以看作由多种物质如:CaCO
3、MgCO
3、Mg(OH)
2等中的若干种物质组成的混合物,某学习小组为研究含有Ca
2+、Mg
2+、HCO
3-的自来水所形成水垢的化学组成,取干燥的水垢6.32g,加热使其失去结晶水后,得到5.78g剩余固体A;高温灼烧A至恒重,残余固体为CaO和MgO,放出的气体用足量Ba(OH)
2溶液吸收,得到11.82g沉淀.
(1)通过计算确定A中的碳酸盐是
c
c
(填答案编号).
a.只有CaCO
3 b.只有MgCO
3 c.既有CaCO
3又有MgCO
3写出计算过程:
n(CO
2)=n(BaCO
3)=
=0.06mol,假设二氧化碳全部来自碳酸钙,则m(CaCO
3)=0.06mol×100g/mol=6g>5.78g,假设二氧化碳全部来自碳酸镁,则m(MgCO
3)=0.06mol×84g/mol=5.04g<5.78g,故A既含有CaCO
3,又含有MgCO
3n(CO
2)=n(BaCO
3)=
=0.06mol,假设二氧化碳全部来自碳酸钙,则m(CaCO
3)=0.06mol×100g/mol=6g>5.78g,假设二氧化碳全部来自碳酸镁,则m(MgCO
3)=0.06mol×84g/mol=5.04g<5.78g,故A既含有CaCO
3,又含有MgCO
3(2)5.78g剩余固体A灼烧至恒重时产生的气体完全被碱石灰吸收,碱石灰增重2.82g,通过计算确定A中各成分的物质的量.若用a CaCO
3?b MgCO
3?x Mg(OH)
2?y H
2O表示原水垢(若a、b、x、y中有为0的,则该项略去,a、b、x、y用最简整数比),通过计算确定原水垢的化学式.
(3)该学习小组用该水垢模拟石灰窑反应,取该水垢与碳粉混合,通入一定量空气(假定不考虑其它气体,N
2与O
2体积比为:4:1),在密闭容器中,用喷灯加热至1000℃左右充分反应后,冷却到室温,测得最后所得气体中各种成分的体积含量如下:
O
2:0.3%;CO:0.4%;CO
2:42.5%;其余为N
2.[已知:Mg(OH)
2分解温度为270℃左右,MgCO
3分解温度为400℃左右,CaCO
3分解温度900℃左右].
求该小组所取水垢和碳粉的质量比(结果保留2位小数).


 (2011?松江区模拟)某固态混合物中含有mgKNO3和若干不溶于水的杂质,将此混合物加入ng水中,在10℃、40℃、75℃时观察,充分溶解后的结果如下(溶解度曲线如图所示):
(2011?松江区模拟)某固态混合物中含有mgKNO3和若干不溶于水的杂质,将此混合物加入ng水中,在10℃、40℃、75℃时观察,充分溶解后的结果如下(溶解度曲线如图所示):