
题目列表(包括答案和解析)
| 元素 | A | B | D |
| 性质或结构信息 | 工业上通过分离液态空气获得其单质,单质能助燃 | 气态氢化物的水溶液显碱性 | 原子有三个电子层,简单离子在本周期中半径最小 |

(A)HN3称为叠氮酸,常温下为无色有刺激性气味的液体。![]() 也被称为类卤离子。用酸与叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:
也被称为类卤离子。用酸与叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:
NaNH2+N2O![]() NaN3+H2O。HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,如溶解铜生成
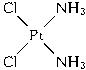
NaN3+H2O。HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,如溶解铜生成![]() 。铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶胞如图)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中B异构体具有可溶性,可用于治疗癌症。试回答下列问题:
。铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶胞如图)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中B异构体具有可溶性,可用于治疗癌症。试回答下列问题:

(1)基态氮原子核外电子排布的轨道表示式为_____________。
(2)元素N、S、P的第一电离能(I1)由大到小的顺序为_____________。
(3)HN3属于_____________晶体,![]() 的空间构型是_____________,与
的空间构型是_____________,与![]() 互为等电子体的分子的化学式为_____________(写1种)。
互为等电子体的分子的化学式为_____________(写1种)。![]() 的电子式为____________,其中心原子的杂化类型是____________。
的电子式为____________,其中心原子的杂化类型是____________。
(4)![]() 中的键型为___________,超导氧化物A的化学式为___________。
中的键型为___________,超导氧化物A的化学式为___________。
(5)治癌药物B的结构简式为___________。
(B)以下是以绿矾、碳酸氢铵和氯化钾为原料制备生产市场较紧俏的硫酸钾产品的新工艺。已知:反应(Ⅰ)的化学方程式为:FeSO4·7H2O+2NH4HCO3![]() FeCO3↓+(NH4)2SO4+CO2↑+H2O
FeCO3↓+(NH4)2SO4+CO2↑+H2O
反应(Ⅱ)的化学方程式为:(NH4)2SO4+2KCl![]() K2SO4+2NH4Cl
K2SO4+2NH4Cl
工艺流程如下:
试回答下列问题:
(1)该工艺中的副产品是____________。(填化学式)
(2)操作C的名称为____________。
(3)原料绿矾、碳酸氢铵的最佳投料比是____________(质量比)时,FeSO4的转化率大于95%。
(4)物质甲是____________(填化学式),反应(Ⅲ)是甲物质与适量空气煅烧,温度为700—
a |
|
|
|
|
|
| b |
|
|
| d | e | f | h |
|
c |
|
| g |
|
| i |
|
(1)“钻石恒久远,一颗永流传。”这句广告词被美国《广告时代》评为20世纪的经典广告之一,说的是上述元素中的_______________(填字母,下同)的一种单质,该广告词能体现的钻石的性质是_____________________。
a.硬度大 b.不能导电 c.化学性质稳定 d.熔点低
(2)钻石晶体中,一个原子位于正四面体的中心,周围四个原子位于四个顶点上,在空间构成连续的、坚固的骨架结构。因此,可以把一块该完美晶体看成一个巨大的“分子”。若有一颗质量为0.6 g的该完美晶体,可以认为它的“相对分子质量”是(阿伏加德罗常数取6.0×1023 mol-1)___________________。
(3)写出一个用金属置换出上表中能形成化合物种数最多的元素的单质的化学反应方程式:________________________________。
(4)2006年7月17日,“发现”号航天飞机出色完成任务后,顺利降落在佛罗里达州肯尼迪航天中心。有同学认为航天飞机内需要有一种化合物来吸收航天员呼出的CO2,同时提供另一种有用的气体,该化合物可能是由上表中的_____________(填字母)元素组成的。可实际上飞船中提供此有用气体的是它的液态单质而不是该化合物,你想这是基于什么考虑?(用文字与方程式简述理由)答:_________________________________________________。
(5)现有另一种元素,其原子获得一个电子所释放出的能量是上表中所列元素中最大的,则X是周期表中第______族元素。
(13分)(1)A、B、D为短周期元素,请根据信息回答问题:
| 元素 | A | B | D |
| 性质或结构信息 | 工业上通过分离液态空气获得其单质,单质能助燃 | 气态氢化物的水溶液显碱性 | 原子有三个电子层,简单离子在本周期中半径最小 |
①第一电离能:A B(填“>”、“=”、“<”),基态D原子的电子排布式为 。
②B和D由共价键形成的某化合物BD在2200℃开始分解,BD的晶体类型为 。
(2)发展煤的液化技术被纳入“十二五规划”,中科院山西煤化所关于煤液化技术的高效催化剂研发项目取得积极进展。已知:煤可以先转化为一氧化碳和氢气,再在催化剂作用下合成甲醇(CH3OH),从而实现液化。
①某含铜离子的离子结构如右图所示:
在该离子内部微粒间作用力的类型有: (填字母)。
A.离子键 B.极性键 C.非极性键 D.配位键 E.范德华力 F.氢键
②煤液化获得甲醇,再经催化得到重要工业原料甲醛(HCHO),甲醇的沸点为65℃,甲醛的沸点为-21℃,两者均易溶于水。甲醇的沸点比甲醛高是因为甲醇分子间存在着氢键,而甲醛分子间没有氢键。甲醇和甲醛均溶于水,是因为它们均可以和水形成分子间氢键。请你说明甲醛分子间没有氢键的原因是 。
③甲醇分子中,进行sp3杂化的原子有 ,甲醛与H2发生加成反应,当生成1mol甲醇时,断裂的∏键的数目为
(13分)(1)A、B、D为短周期元素,请根据信息回答问题:
|
元素 |
A |
B |
D |
|
性质或结构信息 |
工业上通过分离液态空气获得其单质,单质能助燃 |
气态氢化物的水溶液显碱性 |
原子有三个电子层,简单离子在本周期中半径最小 |
①第一电离能:A B(填“>”、“=”、“<”),基态D原子的电子排布式为 。
②B和D由共价键形成的某化合物BD在2200℃开始分解,BD的晶体类型为 。
(2)发展煤的液化技术被纳入“十二五规划”,中科院山西煤化所关于煤液化技术的高效催化剂研发项目取得积极进展。已知:煤可以先转化为一氧化碳和氢气,再在催化剂作用下合成甲醇(CH3OH),从而实现液化。
①某含铜离子的离子结构如右图所示:
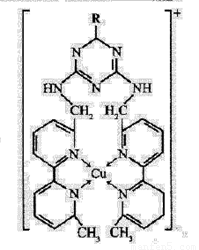
在该离子内部微粒间作用力的类型有: (填字母)。
A.离子键 B.极性键 C.非极性键 D.配位键 E.范德华力 F.氢键
②煤液化获得甲醇,再经催化得到重要工业原料甲醛(HCHO),甲醇的沸点为65℃,甲醛的沸点为-21℃,两者均易溶于水。甲醇的沸点比甲醛高是因为甲醇分子间存在着氢键,而甲醛分子间没有氢键。甲醇和甲醛均溶于水,是因为它们均可以和水形成分子间氢键。请你说明甲醛分子间没有氢键的原因是 。
③甲醇分子中,进行sp3杂化的原子有 ,甲醛与H2发生加成反应,当生成1mol甲醇时,断裂的∏键的数目为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com