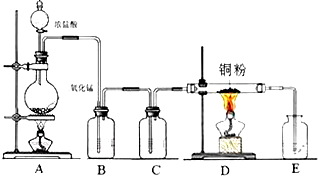
实验室里通常用MnO
2与浓盐酸反应制取氯气.现用下列有关装置先制取干燥、纯净的氯气.后进行有关性质实验.试根据下列有关装置回答有关问题.

(1)上述装置中各仪器从左至右的连接顺序为A接
E
E
接
F
F
接
C
C
接
D
D
接
B
B
接G.
(2)E装置的作用是
除去氯化氢
除去氯化氢
,D中的现象为
湿润的红色布条褪色
湿润的红色布条褪色
,B中的现象为
溶液由无色变为褐色.
溶液由无色变为褐色.
(3)写出相关反应的离子方程式:A中
MnO
2+4H
++2Cl
-Mn
2++Cl
2↑+2H
2O;
MnO
2+4H
++2Cl
-Mn
2++Cl
2↑+2H
2O;
,B中
2I-+Cl2=I2+2Cl-
2I-+Cl2=I2+2Cl-
,G中
Cl2+2OH-=Cl-+ClO-+H2O
Cl2+2OH-=Cl-+ClO-+H2O
.
(4)在制取氯气的反应:MnO
2+4HCl(浓)
MnCl
2+Cl
2↑+2H
2O中,如转移电子的物质的量是4mol,则被氧化的HCl的物质的量是
4
4
mol,有
2
2
mol Cl
2生成.
(5)某温度下,将Cl
2通入NaOH溶液中,反应得到含有ClO
-与ClO
3-物质的量之比为1:1的混合液,反应的化学方程式是
4Cl2+8NaOH═6NaCl+NaClO3+NaClO+4H2O
4Cl2+8NaOH═6NaCl+NaClO3+NaClO+4H2O
.
(6)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件.试根据你的化学知识分析,原因是(用离子方程式表示)
Cl-+ClO-+2H+═Cl2↑+H2O
Cl-+ClO-+2H+═Cl2↑+H2O
.

MnCl2+H2O+Cl2↑。

 实验室里用如图所示装置制取纯净的无水CuCl2.试回答下列问题:
实验室里用如图所示装置制取纯净的无水CuCl2.试回答下列问题: