
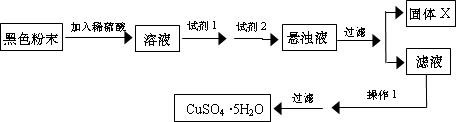
题目列表(包括答案和解析)
实验室中常用中和滴定、氧化还原滴定等方法测定未知浓度的某反应物的物质的量浓度或测定其样品的纯度.
(1)请回答有关指示剂选用的问题
①用已知浓度的盐酸滴定未知浓度的NaOH溶液时,应选择________作指示剂.
②用已知浓度的盐酸滴定未知浓度的![]() 溶液且最终生成
溶液且最终生成![]() 时,应选择________指示剂.
时,应选择________指示剂.
③用已知浓度的![]() 溶液滴定未知浓度的碘水时,应选择________作指示剂.
溶液滴定未知浓度的碘水时,应选择________作指示剂.
④用已知浓度的![]() 溶液滴定未知浓度的硫酸亚铁酸性溶液时,应________指示剂.原因是________.
溶液滴定未知浓度的硫酸亚铁酸性溶液时,应________指示剂.原因是________.
(2)用已知浓度的盐酸滴定未知浓度的稀NaOH溶液时,为减小滴定误差,在选用盐酸的物质的量浓度和体积时,下列四个选项中最佳的是
[ ]
实验实中常用中和滴定、氧化还原滴定等方法测定未知浓度的某反应物的物质的量浓度或测定某样品的纯度.
(1)请回答下列关于指示剂的选用问题:
①用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,应选择________作指示剂.
②用已知浓度的盐酸滴定未知浓度的碳酸钠溶液且最终生成二氧化碳时,应选择________作指示剂.
③用已知浓度的硫代硫酸钠滴定未知浓度的碘水时,应选择________作指示剂.(有关反应的化学方程式为2Na2S2O3+I2![]() Na2S4O6+2NaI)
Na2S4O6+2NaI)
④用已知浓度的高锰酸钾溶液滴定未知浓度的硫酸亚铁酸性溶液时应________指示剂,原因是________.
(2)用已知浓度的盐酸滴定未知浓度的稀氢氧化钠溶液时,为减小滴定误差,在选用盐酸的物质的量浓度和体积时,下列四个选项中最佳的是________(填选项字母).
[ ]
(3)已知基准物是某些纯度高、稳定性好的物质.可在准确称量其质量后直接配制成标准溶液并标定溶液浓度.现有用浓盐酸新配制出的标准溶液,由于________(填写原因)使得浓度不很精确.该盐酸在使用前,需用基准物进行标定.实验室标定标准的盐酸一般选用纯净的无水碳酸钠作基准物.
①上述基准物能否改用纯净的氢氧化钠固体_________(“能”或“不能”);简述理由________.
②某学生误将一种不纯的碳酸钠样品作基准物,则所测得的盐酸浓度将________(填偏高、偏低、无法确定、不受影响).
| 9(b-a) |
| a |
| 9(b-a) |
| a |
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
(15分)二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。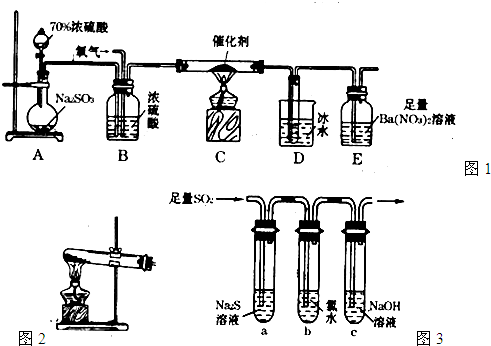
(1)实验室用图1装置测定SO2催化氧化为SO3的转化率。(已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响。)
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作: 。
②实验过程中,需要通入氧气。试写出一个用如图2所示装置制取氧气的化学方程式: 。
③当停止通入SO2熄灭酒精灯后,需要继续通一段时间的氧气,其目的是: 。
④实验结束后,若装置D增加的质量为mg,装置E中产生白色沉淀的质量为ng,则此
条件下二氧化硫的转化率是 (用含字母的代数式表示,不用化简)。
(2)某学习小组设计用如图3装置验证二氧化硫的化学性质。
①能说明二氧化硫具有氧化性的实验现象为: 。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分三份,分别进行如下实验。
方案I:向第一份溶液中加入AgNO3溶液,有白色沉
淀生成。
方案II:向第二份溶液中加入品红溶液,红色褪去。
方案III:向第三份溶液中加入BaC12溶液,产生白色沉淀
上述方案中合理的是 (填“I”、“II”、或“III”);
试管b发生反应的离子方程式: 。
③当通入二氧化硫至试管c中溶液显中性时,该溶液中
c(Na+)= (用含硫微粒浓度的代数式表示)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com