
题目列表(包括答案和解析)

| ||
| ||
 2BO3,在一个固定容积为2L的密闭容器中充入0.20mol的BO2和0.10mol的O2,半分钟后达到平衡,测得容器中含BO3为0.18mol,则v(o2 )=
2BO3,在一个固定容积为2L的密闭容器中充入0.20mol的BO2和0.10mol的O2,半分钟后达到平衡,测得容器中含BO3为0.18mol,则v(o2 )=请完成下列问题(以化学式表示物质或离子):
(1)①298 K时,1 g X气体充分燃烧生成稳定的物质(C元素的单质)放出18.6 kJ的热量,写出该反应的热化学方程式:_______________________________。
②把一定量的X气体和C元素的最高价氧化物对应的水化物Z混合溶于水中,溶液中c(H+)=c(OH-),则X和Z的物质的量之比n(X)∶n(Z)________________。
A.等于1 B.大于1 C.小于1
③以化合物B4A10为燃料,以D元素的单质为助燃剂,以KOH溶液为电解质溶液构成的燃料电池中,负极的电极反应式为_______________________________。
(2)镧系元素在元素周期表的第_______族,镧系元素也叫“稀土”元素,在材料领域应用广泛,我国是“稀土金属”储量丰富的国家之一,铈(Ce)是一种稀土金属,其化合价有+2和+4价,+4价不如+2价稳定,请写出Ce(SO4)2溶液和Na2SO3在稀H2SO4中发生氧化还原反应的离子方程式_______________________________。
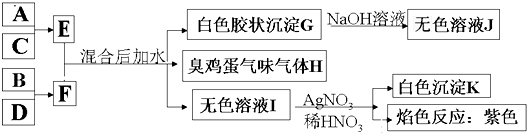
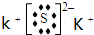
(1)写出元素符号:B______________,D______________。
(2)A、C形成的离子化合物与CO2发生氧化还原反应的化学方程式:______________。
(3)1 mol C的氢氧化物与1 mol B单质在一定条件下恰好完全反应,生成一种盐,水及一种气体,写出该反应的化学方程式:____________________________。
(4)B、C形成的化合物溶于水时,溶液中所有离子的物质的量浓度由大到小的顺序为 ______。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com