
题目列表(包括答案和解析)
石墨晶体由层状石墨“分子”按ABAB方式堆积而成,如右图所示,图中用虚线标出了石墨的一个六方晶胞。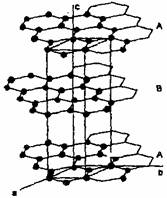
(1)该晶胞的碳原子个数 。
(2)写出晶胞内各碳的原子坐标。
(3)已知石墨的层间距为334.8 pm,C-C键长为142 pm,计算石墨晶体的密度为 。
 石墨可用作锂离子电池的负极材料,充电时发生下述反应:Li1-xC6+x Li++x e-→ LiC6 其结果是,Li+嵌入石墨的A、B层间,导致石墨的层堆积方式发生改变,形成化学式为LiC6的嵌入化合物。
石墨可用作锂离子电池的负极材料,充电时发生下述反应:Li1-xC6+x Li++x e-→ LiC6 其结果是,Li+嵌入石墨的A、B层间,导致石墨的层堆积方式发生改变,形成化学式为LiC6的嵌入化合物。
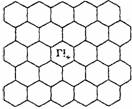
(4)右图给出了一个Li+沿C轴投影在A层上的位置,试在右图上标出与该离子临近的其他6个Li+的投影位置。
(5)在LiC6中,Li+与相邻石墨六元环的作用力属何种键型?
(6)某石墨嵌入化合物每个六元环都对应一个Li+,写出它的化学式。
锂离子电池的正极材料为层状结构的LiNiO2。已知LiNiO2中Li+和Ni3+均处于氧离子组成的正八面体体心位置,但处于不同层中。
(7)将化学计量的NiO和LiOH在空气中加热到770℃可得LiNiO2,试写出反应方程式。
(8)写出LiNiO2正极的充电反应方程式。
(9)锂离子完全脱嵌时 LiNiO2 的层状结构会变得不稳定,用铝取代部分镍形成LiNi1-y Al y O2。可防止理离子完全脱嵌而起到稳定结构的作用,为什么?
已知A、B、C、D、E、F六种元素的原子序数依次递增,都位于前四周期。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍。E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同。F处于周期表中第9列。
(1)B、C、D三种元素的氢化物的沸点高低顺序为 ,稳定性顺序为 。
(2)同时含有A、B、D三种元素的化合物M是此类物质中为数不多的气体,且分子中所有原子共平面,则M中σ键和π键个数比为 ,B原子的杂化类型为 ,M能和水以任意比混溶的原因是 。
(3)C的最高价含氧酸根的空间构型为 ,E的基态原子的价电子排布式
为
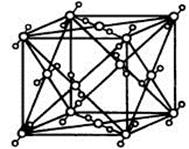
 (4)“生物金属”E内部原子的堆积方式与铜相同,都是面心立方堆积方式,如右图。则E晶胞中E的配位数为 ,若该晶胞的密度为a g/cm3,阿伏加德罗常数为NA,E原子的摩尔质量为M g/mol,则E原子的半径为 cm
(4)“生物金属”E内部原子的堆积方式与铜相同,都是面心立方堆积方式,如右图。则E晶胞中E的配位数为 ,若该晶胞的密度为a g/cm3,阿伏加德罗常数为NA,E原子的摩尔质量为M g/mol,则E原子的半径为 cm
(5)F可形成分子式均为F(NH3)5BrSO4的两种配合物,其中一种化学式为[F(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,产生的现象是 ;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为 。
有A、B、C、D、E五种短周期元素,其原子序数依次增大。A原子的电子层数与它的核外电子总数相同,B原子核外最外层电子数是次外层电子数的2倍,C元素的原子基态时2p能级是2s能级上的电子数的2倍,D是该周期中原子半径最大的主族元素,E原子的第一至第四电离能(kJ·mol-1)分别为:578、1817、2745、11575。请回答下列问题: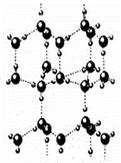
(1)C、D两元素形成的化合物的晶体类型是 。BC2的结构式 ;在一定温度下,用x射线衍射法测BC2晶胞(晶体中最小的重复单位)边长: a=5.72×10-8cm,该温度下BC2的密度为
(2)若F是D的同主族下一周期元素,则F的电子排布式是: ,
(3)写出E的最高价氧化物对应的水化物与D的最高价氧化物对应的水化物反应的离子方程式 。
(4)A2C分子间因存在“氢键”的作用而彼此结合形成(A2C)n。在该分子形成的晶体中每个A2C分子被4个A2C分子包围形成变形的四面体,通过“氢键”相互连接成庞大的分子晶体,其结构示意图如右图所示,试填空。
①含1molA2C的该晶体中有_____mol“氢键”。
②若G是C的同主族下一周期元素,请比较A2C与A2G沸点的高低______________。(填分子式)
有A、B、C、D、E五种短周期元素,其原子序数依次增大。A原子的电子层数与它的核外电子总数相同,B原子核外最外层电子数是次外层电子数的2倍,C元素的原子基态时2p能级是2s能级上的电子数的2倍,D是该周期中原子半径最大的主族元素,E原子的第一至第四电离能(kJ·mol-1)分别为:578、1817、2745、11575。请回答下列问题:

(1)C、D两元素形成的化合物的晶体类型是 。BC2的结构式 ;在一定温度下,用x射线衍射法测BC2晶胞(晶体中最小的重复单位)边长: a=5.72×10-8cm,该温度下BC2的密度为
(2)若F是D的同主族下一周期元素,则F的电子排布式是: ,
(3)写出E的最高价氧化物对应的水化物与D的最高价氧化物对应的水化物反应的离子方程式 。
(4)A2C分子间因存在“氢键”的作用而彼此结合形成(A2C)n。在该分子形成的晶体中每个A2C分子被4个A2C分子包围形成变形的四面体,通过“氢键”相互连接成庞大的分子晶体,其结构示意图如右图所示,试填空。
①含1molA2C的该晶体中有_____mol“氢键”。
②若G是C的同主族下一周期元素,请比较A2C与A2G沸点的高低______________。(填分子式)
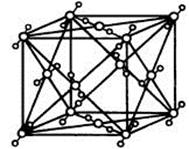
 (10分)已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F。其中B、D、F原子最外电子层的P能级(轨道)上的电子处于半满状态。通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右下图所示。E的电负性在该周期中最大。镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaF为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料。
(10分)已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F。其中B、D、F原子最外电子层的P能级(轨道)上的电子处于半满状态。通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右下图所示。E的电负性在该周期中最大。镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaF为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料。
试回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)
(1)基态Ga原子的核外电子排布式为 。
(2)A、B、C的第一电离能由大到小的顺序为 。
(3)B元素的单质分子中有 个π键。
(4)上述A的氧化物分子中心原子采取______杂化,其晶胞中微粒间的作用力为 。
(5)FH3沸点与比BH3 (填“高”或“低”),原因是 。
(6)固体CrE3?6H2O溶于水可能有几种不同组成的配离子,实验将含0.2665gCrE3?6H2O的溶液通过H-离子交换树脂(只交换配阳离子),交换出的酸用0.125mol/L的氢氧化钠溶液8.00mL中和。已知配离子配位数为6,则该配离子是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com