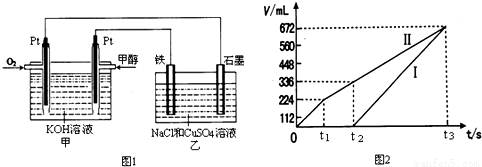
(2012?天津模拟)甲醇是一种可再生能源,用途广泛,一种由甲醇、氧气以及强碱溶液制成的新型手机电池,容量达氢镍电池或锂电池的10倍.回答下列有关问题:
(1)工业上有一种生产甲醇的反应:
CO
2(g)+3H
2(g)?CH
3OH(g)+H
2O(g)△H=-49.0kJ?mol
-1在某温度下,容积均为1L的A、B两个容器中,按不同方式投入反应物,保持恒温恒容,经10秒钟后达到平衡,达到平衡时的有关数据如下表:
| 容器 |
A |
B |
| 反应物投入量 |
1mol CO2(g)和3mol H2(g) |
1mol CH3OH(g)和1mol H2O(g) |
| CH3OH(g)浓度(mol?L-1) |
c1 |
c2 |
| 反应能量变化 |
放出29.4kJ |
吸收akJ |
①从反应开始至达到平衡时,A中用CO
2来表示的平均反应速率为
0.06mol/(L?S)
0.06mol/(L?S)
.
②该温度下,反应CO
2(g)+3H
2(g)?CH
3OH(g)+H
2O(g) 的化学平衡常数的值为
0.12
0.12
.
③a=
19.6
19.6
.
④下列措施中能使n(CH
3OH)/n(CO
2)增大的是
BC
BC
.
A.升高温度 B.充入氢气
C.将水蒸气从体系中分离 D.用更有效的催化剂
(2)某同学设计了一个甲醇燃料电池,并用该电池电解200mL一定浓度的NaCl与CuSO
4混合溶液,其装置如图1:
①写出甲中通入甲醇一极的电极反应式
CH3OH-6e-+8OH-=CO32-+6H2O
CH3OH-6e-+8OH-=CO32-+6H2O
.
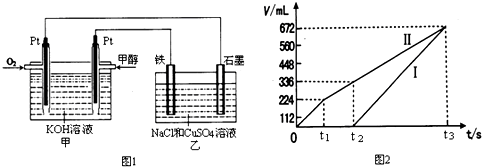
②图2中曲线Ⅰ、Ⅱ分别表示乙中两极所得气体的体积随时间变化的关系(气体体积已换算成标准状况下的体积),写出电解开始时铁极上的电极反应式
Cu2++2e-=Cu
Cu2++2e-=Cu
;
t
1后石墨电极上的电极反应式
4OH--4e-=O2↑+2H2O
4OH--4e-=O2↑+2H2O
;计算在t
2时所得溶液的pH为(忽略电解前后溶液体积的变化)
1
1
.