
题目列表(包括答案和解析)
 实验室用H2O2分解反应制取氧气时,常加入催化剂以加快反应速率,某研究性学习小组为研究催化剂FeCl3的量对O2生成速率的影响,设计了如下三组实验方案(见下表),将表中所给的试剂按一定体积混合后进行反应.
实验室用H2O2分解反应制取氧气时,常加入催化剂以加快反应速率,某研究性学习小组为研究催化剂FeCl3的量对O2生成速率的影响,设计了如下三组实验方案(见下表),将表中所给的试剂按一定体积混合后进行反应.| 实验编号 试剂 |
A | B | C |
| 10% H2O2/mL | 20.0 | V1 | V2 |
| 2mol/L FeCl3/mL | 0 | 5.0 | 10.0 |
| H2O/mL | V3 | V4 | 0 |
某芳香族化合物A在一定条件下能发生如下图转化,部分产物已略去。气体F对
氢气的相对密度为22。

请按要求回答下列问题:
(1)E的分子式是_____________;B的结构式为_____________;C的含氧官能团有(写名称)
_____________;反应⑦的反应类型是_____________。
(2)设计反应①、⑥的目的是____________________________________________。
(3)写出下列反应的化学方程式:
反应④:_________________________________________________________________;
反应⑤:_________________________________________________________________。
(4)A的结构简式是_______________________________________。
(5)己知有机物H比C的分子少一个CH2,且H具有如下性质:①遇FeCl3溶液发生显色反应;②一
定条件下能发生水解反应;③分子中苯环上仅有两个相邻取代基。则H同分异构体的数目为_________;
其结构简式之一为____________________________________________________。
(10分)Cu—Fe合金由于长时间置于空气中表面产生了一层氧化膜(成分为Fe2O3和CuO),一化学研究性学习小组对其进行如下探究,请按要求完成下列探究报告。
探究目的:实验测定样品中Fe,Cu的质量。
探究思路:设计实验测量有关反应物和生成物的量,并通过计算确定样品中Fe,Cu的质量。
实验探究:(本实验中的气体体积均已换算成标准状况)
① 将此合金5.76g置于烧杯中,然后将稀H2SO4逐渐缓慢加入至过量,收集产生的气体测得其体积为VmL。过滤得浅绿色溶液A(不含Cu2+),还有滤渣B。
② 将滤渣B投入到一定浓度的HNO3中,完全溶解,收集产生的气体,经分析气体是NO和NO2的混合气体,总体积896mL,其中NO2体积为224mL。
③ 将①中所得的滤液加入到足量的同浓度HNO3中,充分反应后再加入足量的NaOH溶液,将产生的沉淀全部滤出,充分加热灼烧得红棕色固体,称量该固体的质量为3.2g。
结果处理:
(1) A中存在的阳离子有 ,滤渣B为 。
(2) 被腐蚀前的合金中Fe的质量为 g,Cu的质量为 g。
(3) 实验探究①中V为 mL (本小题需写出计算过程,可以直接利用(2)小题计算结果)
(9分)实验室用H2O2分解反应制取氧气时,常加入催化剂以加快反应速率,某研究性学习小组为研究催化剂FeCl3的量对O2生成速率的影响,设计了如下三组实验方案(见下表),将表中所给的试剂按一定体积混合后进行反应。
| 实验编号 试剂 | A | B | C |
| 10% H2O2/mL | 20.0 | V1 | V2 |
| 2mol/L FeCl3/ mL | 0 | 5.0 | 10.0 |
| H2O/ mL | V3 | V4 | 0 |
按要求回答下列问题:
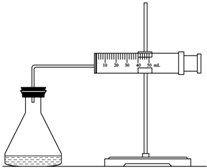
(1)欲用右图装置来比较该反应的反应速率快慢,当反应物的浓度、用量及其他影响速率的条件确定之后,可以通过测 推(计)算反应速率。
(2)为实现实验目的,则V1= ,V2= ;
V3= ,V4= 。
(3)根据你所掌握的知识判断,在上述实验中反应速率最快的可能是 (填“实验编号”)
(4)已知Fe3+催化H2O2分解的机理可分两步反应进行,其中第一步反应为:2Fe3+ + H2O2 ==2Fe2++ O2↑+ 2H+,则第二步反应的离子方程式为:
。
【解析】(1)因为反应中生成氧气,所以可以通过收集相同体积的气体所需要的时间来进行计算。
(2)为使实验在相同条件下进行双氧水的量应该相同,且最终溶液的体积要相同,所以V1=20.00ml,V2=20.00ml,V3=10.00ml,V4=5.00ml。
(3)C中催化剂的量最多,所以反应速率可能最快。
(4)因为催化剂在反应前后是不能变的,所以在第二步中亚铁离子要重新生成铁离子,因此正确的反应式为2Fe2+ + H2O2 +2H+ == 2Fe3+ + 2H2O。
(9分)实验室用H2O2分解反应制取氧气时,常加入催化剂以加快反应速率,某研究性学习小组为研究催化剂FeCl3的量对O2生成速率的影响,设计了如下三组实验方案(见下表),将表中所给的试剂按一定体积混合后进行反应。
|
实验编号 试剂 |
A |
B |
C |
|
10% H2O2/mL |
20.0 |
V1 |
V2 |
|
2mol/L FeCl3/ mL |
0 |
5.0 |
10.0 |
|
H2O/ mL |
V3 |
V4 |
0 |
按要求回答下列问题:
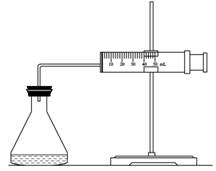
(1)欲用右图装置来比较该反应的反应速率快慢,当反应物的浓度、用量及其他影响速率的条件确定之后,可以通过测 推(计)算反应速率。
(2)为实现实验目的,则V1= ,V2= ;
V3= ,V4= 。
(3)根据你所掌握的知识判断,在上述实验中反应速率最快的可能是 (填“实验编号”)
(4)已知Fe3+催化H2O2分解的机理可分两步反应进行,其中第一步反应为:2Fe3+ + H2O2 ==2Fe2+ + O2↑+ 2H+,则第二步反应的离子方程式为:
。
【解析】(1)因为反应中生成氧气,所以可以通过收集相同体积的气体所需要的时间来进行计算。
(2)为使实验在相同条件下进行双氧水的量应该相同,且最终溶液的体积要相同,所以V1=20.00ml,V2=20.00ml,V3=10.00ml,V4=5.00ml。
(3)C中催化剂的量最多,所以反应速率可能最快。
(4)因为催化剂在反应前后是不能变的,所以在第二步中亚铁离子要重新生成铁离子,因此正确的反应式为2Fe2+ + H2O2 + 2H+ == 2Fe3+ + 2H2O。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com