
题目列表(包括答案和解析)
(1)某温度(t℃)时,水的离子积为Kw=1×10-13,则该温度 25℃(填“>”“=”或“<”),在此温度下,某溶液中由水电离出来的H+浓度为1×10-10mol/L,则该溶液的pH可能为 或 。
若温度为25℃时,体积为Va、pH=a的H2SO4溶液与体积为Vb、pH=b的NaOH溶液混合,恰好中和.已知Va>Vb,且a=0.5 b,则a的取值范围 。
(3)若将此温度(t℃)下,pH=11的苛性钠溶液m L与pH=1的稀硫酸溶液nL混合(假设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比,并比较溶液中各离子的浓度大小。
①若所得混合液为中性,则m∶n= ;此溶液中各种离子的浓度由大到小排列顺序是 。
②若所得混合液的pH=2,则m∶n= ;此溶液中各种离子的浓度由大到小排列顺序是 。
(1)某温度(t℃)时,水的离子积为Kw=1×10-13,则该温度 25℃(填“>”“=”或“<”),在此温度下,某溶液中由水电离出来的H+浓度为1×10-10mol/L,则该溶液的pH可能为 或 。
若温度为25℃时,体积为Va、pH=a的H2SO4溶液与体积为Vb、pH=b的NaOH溶液混合,恰好中和.已知Va>Vb,且a=0.5 b,则a的取值范围 。
(3)若将此温度(t℃)下,pH=11的苛性钠溶液m L与pH=1的稀硫酸溶液nL混合(假设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比,并比较溶液中各离子的浓度大小。
①若所得混合液为中性,则m∶n= ;此溶液中各种离子的浓度由大到小排列顺序是 。
②若所得混合液的pH=2,则m∶n= ;此溶液中各种离子的浓度由大到小排列顺序是 。
(1)某温度(t℃)时,水的离子积为Kw=1×10-13,则该温度 25℃(填“>”“=”或“<”),在此温度下,某溶液中由水电离出来的H+浓度为1×10-10mol/L,则该溶液的pH可能为
或 。
若温度为25℃时,体积为Va、pH=a的H2SO4溶液与体积为Vb、pH=b的NaOH溶液混合,恰好中和.已知Va>Vb,且a=0.5 b,则a的取值范围 。
(3)若将此温度(t℃)下,pH=11的苛性钠溶液m L与pH=1的稀硫酸溶液nL混合(假设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比,并比较溶液中各离子的浓度大小。
①若所得混合液为中性,则m∶n= ;此溶液中各种离子的浓度由大到小排列顺序是 。
②若所得混合液的pH=2,则m∶n= ;此溶液中各种离子的浓度由大到小排列顺序是 。
化学学科中的化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。
请回答下列问题:
 (1)工业上采取CO和H2为原料合成乙醇,其化学反应方程式为:2CO(g)+4H2(g)??
(1)工业上采取CO和H2为原料合成乙醇,其化学反应方程式为:2CO(g)+4H2(g)??
CH3CH2OH(g)+H2O(g)。请写出该反应的化学平衡常数表达式K=________。
(2)常温下,浓度均为0.1 mol·L-1的六种溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | Na2SO4 |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 7.0 |
①上述盐溶液中的阴离子,结合质子能力最强的是________。
②根据表中数据,浓度均为0.01 mol·L-1的下列五种物质的溶液中,酸性最强的是________(填字母);将各溶液分别稀释100倍,pH变化最小的是________(填字母)。
A.HCN B.HClO C.H2SO4 D.CH3COOH E.H2CO3
③把CO2气体通入饱和碳酸钠溶液中,可以观察到的现象为________,原因为________(用离子方程式表示)。
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为____________。
(3)某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是_______。
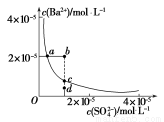
A.加入适量BaCl2(固体)可以使溶液由d点变到c点
B.通过加水稀释可以使溶液由b点变到a点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp等于c点对应的Ksp
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com