
题目列表(包括答案和解析)
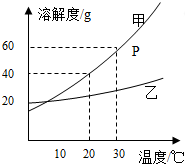 如图是甲乙两种固体物质的溶解度曲线.据图回答:
如图是甲乙两种固体物质的溶解度曲线.据图回答: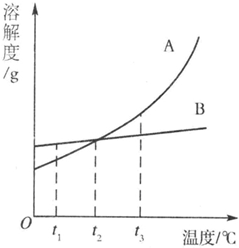 如图是A、B两种固体物质的溶解度曲线.
如图是A、B两种固体物质的溶解度曲线.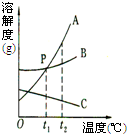 30、右图是A、B、C三种固体物质的溶解度曲线,请回答:
30、右图是A、B、C三种固体物质的溶解度曲线,请回答: (2012?日照)甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答:
(2012?日照)甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答: (2013?江西模拟)甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答:
(2013?江西模拟)甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答:湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com