
题目列表(包括答案和解析)





 [化学-选修物质结构与性质]现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图所示的结构或结构单元(图形以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同).A、B的晶体类型相同,单质A的同素异形体能与B物质发生置换反应.C、D、E、F含有相同的电子数,且D是阳离子,D与F的组成元素相同.C、E、F的晶体类型相同,由E构成的物质常温下呈液态.
[化学-选修物质结构与性质]现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图所示的结构或结构单元(图形以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同).A、B的晶体类型相同,单质A的同素异形体能与B物质发生置换反应.C、D、E、F含有相同的电子数,且D是阳离子,D与F的组成元素相同.C、E、F的晶体类型相同,由E构成的物质常温下呈液态.[化学—物质结构与性质]
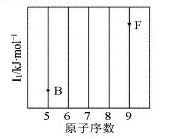
(1)依据第2周期元素第一电离能的变化规律,参照下图B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置。
(2)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:4NH3+3F2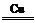 NF3+3NH4F
NF3+3NH4F
①上述化学方程式中的5种物质所属的晶体类型有_________(填序号)。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
②基态铜原子的核外电子排布式为________。
(3)BF3与一定量水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:
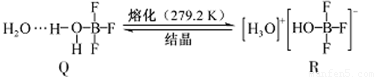
①晶体Q中各种微粒间的作用力不涉及___________(填序号)。
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.范德华力
②R中阳离子的空间构型为_______,阴离子的中心原子轨道采用_______杂化。
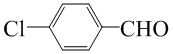
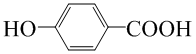
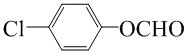
(4)已知苯酚(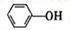 )具有弱酸性,其Ka=1.1 ×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1 ×10-10;水杨酸第一级电离形成的离子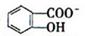 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是__________。
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是__________。
化学家利用钯(Pd)作催化剂,将有机化合物进行“裁剪”“缝合”,创造出具有特殊功能的新物质而荣获2010年诺贝尔化学奖。赫克反应(Heck反应)的通式可表示为:
(R—X中的R通常是不饱和烃基或苯环;R′CH=CH2通常是丙烯酸酯或丙烯腈CH2=CH—CN等):
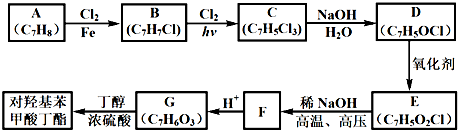
现有A、B、C、D等有机化合物有如下转化关系(部分反应条件省略)
请回答下列问题:
(1)反应Ⅰ的化学方程式为__________________________________________________。
(2)已知腈基(—C≡N)也具有不饱和性(可催化加氢),写出CH2=CH—CN完全催化加氢的化学方程式:________________________________________。写出上述催化加氢后的产物的同分异构体的结构简式________________________________________。
(3)丙烯腈(CH2=CH—CN)可发生加聚反应生成一种高聚物,此高聚物的结构简式为______________________________。
(4)写出B转化为C的化学方程式:______________________________反应类型为__________。
(5)D的结构简式为(必须表示出分子的空间构型)______________________________。
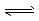 CH3CH2OH(g) +3H2O(g) △H=akJ.mol-1 在一定压强下,测得上述反应的实验数据如下表。
CH3CH2OH(g) +3H2O(g) △H=akJ.mol-1 在一定压强下,测得上述反应的实验数据如下表。 

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com