
题目列表(包括答案和解析)
| a | ||||
| b | c | |||
| d | e | |||
| f |
| A、b、c、e三种元素的原子半径大小关系:e>b>c |
| B、六种元素中,d元素的性质最稳定 |
| C、c的氢化物比f的氢化物的沸点低 |
| D、f元素的氢化物不是强电解质 |
(16分) A、B、C、D、E、F是元素周期表中六种短周期元素,请根据表中信息回答下列问题
| 元素 | A | B | C | D | E | F |
|
性质或结构 信息 | 形成化合物种类最多的元素 | 最高正价是最低负价绝对值的3倍 | 族序数等于周期数的3倍 | 周期数是族序数的3倍 | 地壳中含量最高的金属元素 | 最高价氧化物对应水化物是最强的含氧酸 |
(1)元素B 的离子结构示意图 元素F的最高价氧化物的化学式为 。
(2)元素A、D分别与元素C 形成原子个数比为1:2的化合物甲和1:1 的化合物乙,则甲属于 分子(填“极性”或“非极性”),化合物乙的电子式 ,甲与乙反应的化学方程式为 。
(3)元素B、D组成化合物丙,其晶体类型为 ,化合物丙的溶液呈 (填“酸性”“碱性”或“中性”)。
(4)元素A与氢元素组成的最简单的化合物丁是一种优质燃料,燃烧热值高。
①实验测得,在常温常压下,1g化合物丁完全燃烧生成液态水,放出55.65 kJ 热量。则表示化合物丁的燃烧热的热化学方程式为 。
②某实验小组依据丁燃烧的反应原理,设计如右图所示的电池装置。
a.该电池正极的电极反应为 。
b.工作一段时间后,测得溶液的pH减小,该电池总反应的离子方程式为 。
(5)G也是短周期元素,其核外电子层数与最外层电子数相等,且与E处于元素周期表中对角线位置,它们的单质及其化合物的性质相似,写出G的氧化物与NaOH溶液反应的离子方程式: 。若E的氯化物熔沸点较低、易升华,则E的氯化物是 化合物(填“离子”或“共价”),试设计一个简单实验证明你的选择 。
(16分) A、B、C、D、E、F是元素周期表中六种短周期元素,请根据表中信息回答下列问题
| 元素 | A | B | C | D | E | F |
| 性质或结构 信息 | 形成化合物种类最多的元素 | 最高正价是最低负价绝对值的3倍 | 族序数等于周期数的3倍 | 周期数是族序数的3倍 | 地壳中含量最高的金属元素 | 最高价氧化物对应水化物是最强的含氧酸 |

A、B、C、D、E、F是元素周期表中前20号元素,它们的原子序数依次增大。A、B可分别与C组成常见化合物AC、AC2、BC、BC2;D元素的焰色反应呈黄色;E、F两元素单质的沸点与元素原子序数的关系如图(图中原子序数连续)。

(1)A在元素周期表中的位置是 。
(2)B2的电子式为 ,C、D、F对应的简单离子半径由小到大的顺序为 (用离子符号表示)。
(3)C、F的单质或两元素之间形成的化合物可作水消毒剂的有 (写出其中两种物质的化学式)。
(4)化合物Y由C、E两元素组成,将Y、B单质与A单质按1∶1∶3在一定条件下反应可得到Z和AC,Z的化学式为 。
图中a、b、c、d、e、f为元素周期表中前4周期的一部分元素,下列有关叙述正确的是
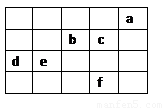
A.b、c、e三种元素的原子半径大小关系:e>c>b
B.六种元素分别形成的单质固体中,d的熔、沸点最高
C.c的氢化物沸点比f的氢化物沸点低
D.b元素除0价外,只有一种化合价
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com