
题目列表(包括答案和解析)
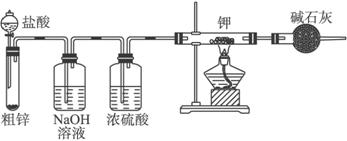
(1)请你评价实验方案,找出每套方案的优缺点,填写下表:
| 方案Ⅰ | 方案Ⅱ | 方案Ⅲ |
优点 |
|
|
|
缺点 |
|
|
|
(2)请你设计一套合理方案,并画出实验装置图。
(3)根据合理方案进行实验,其实验步骤如下:A.检查装置气密性;B.装药品;C.停止加热;D.打开分液漏斗的活塞;E.通一会儿气体;F.收集气体并检验气体纯度;G.关闭分液漏斗活塞;H.加热。
①正确的操作顺序是:__________(填编号,同一操作可以重复用);②检验气体纯度的目的是________________,③从安全角度考虑,尾气的正确处理方法是____________________。
(4)根据氢化钾(KH)的制备成为事实,你推测氢元素与下列哪些元素有相似的性质,并简述理由________________________________。
A.碳 B.氧 C.钠 D.氯 E.镁
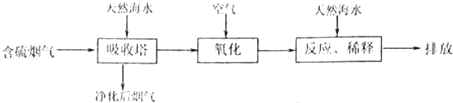
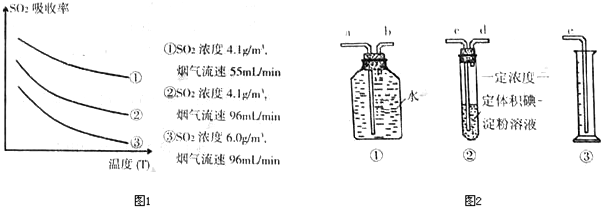
中学化学中氢元素常常在化合物中显+1价,但氢是非金属元素,是否也有负价呢?科学家经过研究,已合成了氢化钾、氢化钠等碱金属氢化物,其反应为:2K+H2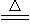 2KH。已知KH为白色固体,极易与水反应:KH+H2O=KOH+H2↑。某研究学习小组设计了下列三套方案:
2KH。已知KH为白色固体,极易与水反应:KH+H2O=KOH+H2↑。某研究学习小组设计了下列三套方案: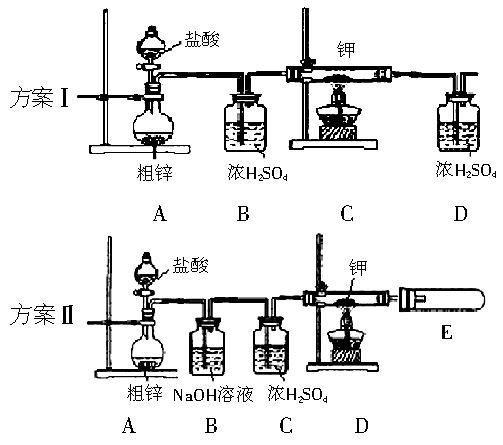
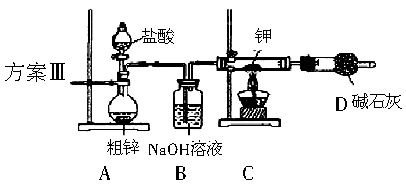
(1)请你评价三套实验方案,找出每套方案的优缺点,填入下表: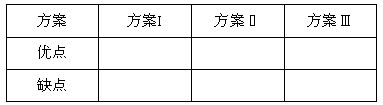
(2)请你设计一套合理方案,根据合理方案进行实验,其步骤如下:
A.检验装置气密性;B.装药品;C.停止加热;D.打开分液漏斗;E.通一会儿气体;F.收集并检验气体纯度;G.关闭分液漏斗活塞;H.加热
①正确的操作顺序是_________(填序号,同一操作可重复使用);②检验气体纯度的目的是_________;③从安全角度考虑,尾气的正确处理方法是_________
____________。
(3)根据制备氢和钾的化合物KH已成为事实,请你推测氢元素具备下列元素某些性质的是_________,理由是_________。
A.碳 B.氧 C.钠 D.氯 E.镁
| ||
| ||
| ||

| ||
| ||
 (2009?广东)甲酸甲酯水解反应方程式为:
(2009?广东)甲酸甲酯水解反应方程式为: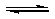 HCOOH(l)+CH3OH(l)△H>0
HCOOH(l)+CH3OH(l)△H>0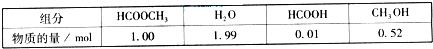

| c(HCOOH)?c(CH3OH) |
| c(HCOOCH3)?c(H2O) |
| 1 |
| 7 |
| 1 |
| 7 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com