
题目列表(包括答案和解析)
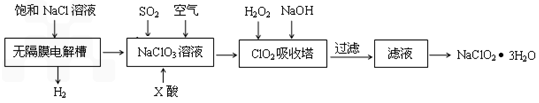
亚氯酸钠(NaClO2)是一种重要的消毒剂,主要用于水、砂糖、油脂的漂白与杀菌。以下是制取亚氯酸钠的工艺流程:
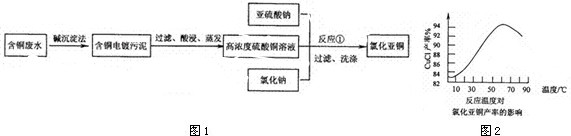
已知:①NaClO2的溶解度随着温度升高而增大,适当条件下可结晶析出。
②ClO2气体只能保持在稀释状态下以防止爆炸性分解,且需现合成现用。
③ClO2气体在中性和碱性溶液中不能稳定存在。
(1)在无隔膜电解槽中持续电解一段时间后,生成氢气和NaClO3,请写出阳极的电极反应方程式: 。
(2)反应生成ClO2气体需要X酸酸化的原因为: 。X酸为 。
(3)吸收塔内的温度不能过高的原因为:
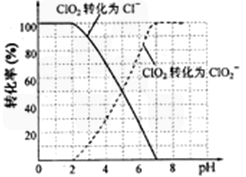
(4)吸收塔内ClO2随着还原剂的不同和溶液酸碱性的变化可被还原为ClO2—或Cl—。ClO2被S2—还原为ClO2—、Cl—的转化率与溶液pH的关系如右图所示。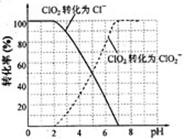
请写出pH≤2时ClO2与S2—反应的离子方程式: 。
(5)第二步向NaClO3溶液中通SO2的同时通入空气的原因为: 。
(6)从滤液中得到NaClO2●3H2O粗晶体的操作步骤为
、 、 。
亚氯酸钠(NaClO2)是一种重要的消毒剂,主要用于水、砂糖、油脂的漂白与杀菌。以下是制取亚氯酸钠的工艺流程:

已知:①NaClO2的溶解度随着温度升高而增大,适当条件下可结晶析出。
②ClO2气体只能保持在稀释状态下以防止爆炸性分解,且需现合成现用。
③ClO2气体在中性和碱性溶液中不能稳定存在。
(1)在无隔膜电解槽中持续电解一段时间后,生成氢气和NaClO3,请写出阳极的电极反应方程式: 。
(2)反应生成ClO2气体需要X酸酸化的原因为: 。X酸为 。
(3)吸收塔内的温度不能过高的原因为:
(4)吸收塔内ClO2随着还原剂的不同和溶液酸碱性的变化可被还原为ClO2—或Cl—。ClO2被S2—还原为ClO2—、Cl—的转化率与溶液pH的关系如右图所示。

请写出pH≤2时ClO2与S2—反应的离子方程式: 。
(5)第二步向NaClO3溶液中通SO2的同时通入空气的原因为: 。
(6)从滤液中得到NaClO2●3H2O粗晶体的操作步骤为
、 、 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com