
题目列表(包括答案和解析)
氮气与氢气反应生成氨气的平衡常数见下表:
| | N2+3H2 2NH3 2NH3 | |||
| 温度 | 25℃ | 200℃ | 400℃ | 600℃ |
| 平衡常数K | 5×108 | 650 | 0.507 | 0.01 |
| | N2+3H2 2NH3 2NH3 | |||
| 温度 | 25℃ | 200℃ | 400℃ | 600℃ |
| 平衡常数K | 5×108 | 650 | 0.507 | 0.01 |
在容积不同的多个密闭容器内,分别充入同量的N2和H2,在不同温度下,同时发生反应N2+3H2![]() 2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如右:
2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如右:
(1)A,B,C,D,E五点中,尚未达到化学平衡状态的点是 。
(2) 向一恒容容器中加入1 mol N2 和3 mol H2,T3时,测得体系
压强为原来的7/8,并放出23.1 kJ的热量,则该反应的热化学方程式
为 。
(3)当上述反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高NH3
产率的有 (填字母)
A 升高温度 B 降低温度 C 增大压强 D 减小压强
E 加入催化剂 F 吸收NH3 G 通入N2
(4)AC段的曲线和CE段曲线变化趋势相反,试从反应速率和平衡角度说明理由。
。

|
在一定温度下,向V L体积固定的密闭容器中加入1 mol N2和3 mol H2,发生如下反应:N2+3H2 ①容器内压强不随时间变化而变化 ②混合气体的密度不随时间变化而变化 ③NH3的浓度不再变化 ④N2、H2、NH3的浓度之比为1∶3∶2 ⑤N2、H2的转化率相等 | |
| [ ] | |
A. |
①②③ |
B. |
②③⑤ |
C. |
①③ |
D. |
④⑤ |
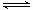 2NO
2NO | 温度 | 27℃ | 2000℃ |
| K值 | 3.84×10-31 | 0.1 |
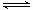 2NH3
2NH3 | 温度 | 25℃ | 350℃ | 400℃ | 450℃ |
| K值 | 5×108 | 1.847 | 0.507 | 0.152 |
 2NO是吸热反应
2NO是吸热反应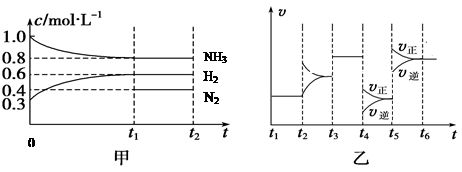
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com